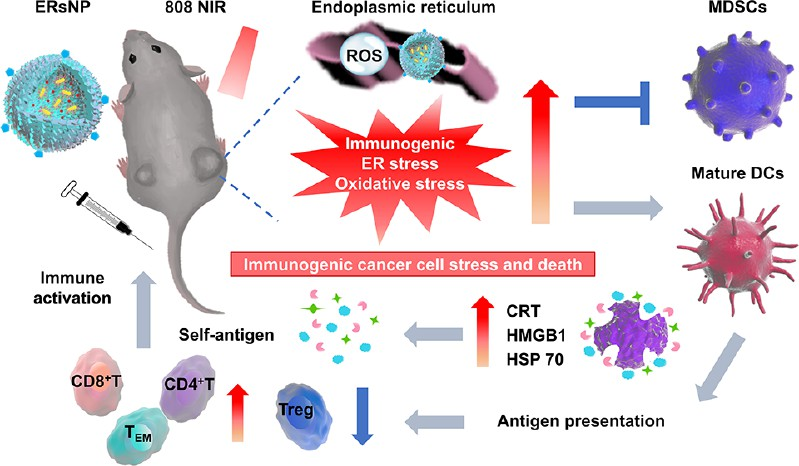
癌癥的進展和治療相關的細胞應激可通過誘導耐藥而影響治療效果。內質網(ER)應激是該過程的核心事件。異常激活應激傳感器及其下游成分破壞體內平衡已成為腫瘤進展和癌癥治療反應的重要調節因子。有鑒于此,北京大學齊憲榮教授設計了一種納米光誘導劑(ERsNP),其能夠實現特異性的腫瘤內質網歸巢,以誘導熱療和與氧化應激相關的活性氧(ROS)增加,并且能夠在近紅外激光的照射下引起強烈且致命的內質網應激。
本文要點:
(1)由內質網應激和ROS強化的"死亡"能夠誘導原發性和遠端B16F10和GL261腫瘤的細胞凋亡,并促進損傷相關的分子模式,以引發應激依賴性免疫原性細胞死亡效應和"自抗原"的釋放。研究發現,該納米光誘導劑可通過級聯反應促進樹突狀細胞的成熟、重編程髓源性抑制細胞以調控免疫抑制、募集細胞毒性T淋巴細胞和產生有效的抗腫瘤反應。
(2)基于趨化因子(C?C基序)受體2拮抗劑、激光照射的ERsNP和免疫檢查點抑制劑的術前和術后級聯組合光免疫療法能夠產生長期的保護作用以對抗腫瘤復發。實驗結果表明,該納米光誘導劑能夠通過增強內質網應激和氧化應激誘導有效的免疫原性細胞應激和死亡,從而提高腫瘤光免疫治療的療效。
Zhenzhen Yang. et al. Reinforced Immunogenic Endoplasmic Reticulum Stress and Oxidative Stress via an Orchestrated Nanophotoinducer to Boost Cancer Photoimmunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.3c13143
https://pubs.acs.org/doi/10.1021/acsnano.3c13143



















