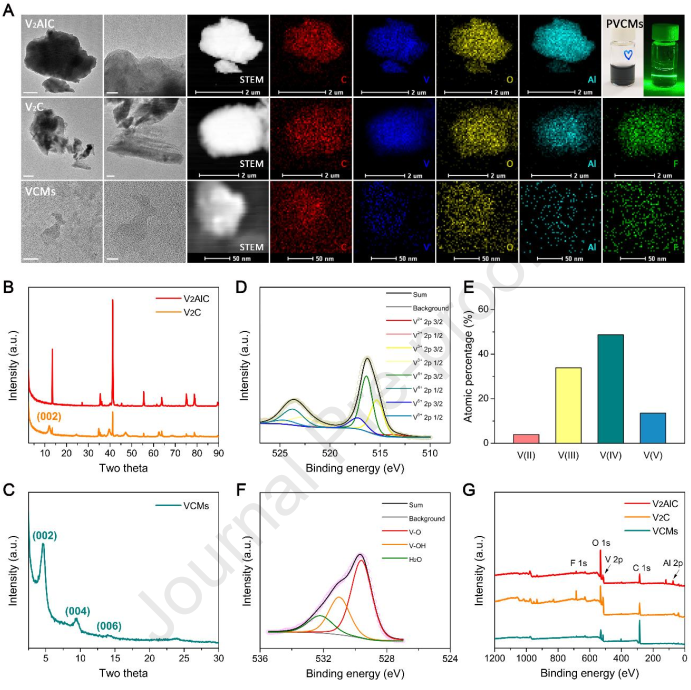
用于鐵死亡治療的抗癌納米藥物通常依賴于芬頓催化劑的直接遞送,以驅動癌細胞的脂質過氧化。然而,細胞內抗鐵死亡信號引起的鐵死亡抗性仍會嚴重限制鐵死亡的治療效果。有鑒于此,中國科學院長春應化所曲曉剛研究員和任勁松研究員構建了模擬ATP酶活性的碳化釩MXene納米酶(PVCMs),其能夠通過藥理學方式調節核因子e2相關因子2 (Nrf2)程序。Nrf2程序是三陰性乳腺癌(TNBC)細胞的鐵死亡防御系統中的主要抗鐵死亡介質。
本文要點:
(1)PVCMs具有較高的類ATP酶活性,可以有效地選擇性催化ATP發生去磷酸化,以產生ADP。
(2)實驗結果表明,PVCMs可通過由能量狀態下降啟動的級聯機制有效地阻礙Nrf2程序,從而響應PVCMs誘導的谷胱甘肽耗竭以選擇性地驅動三陰性乳腺癌細胞發生鐵死亡。綜上所述,該研究能夠為利用具有藥理活性的納米酶調節特定的細胞信號和產生治療所需的藥理活性提供一個新的范例。
Huan Wang. et al. An ATPase-Mimicking MXene nanozyme pharmacologically breaks the ironclad defense system for ferroptosis cancer therapy. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224000577




















