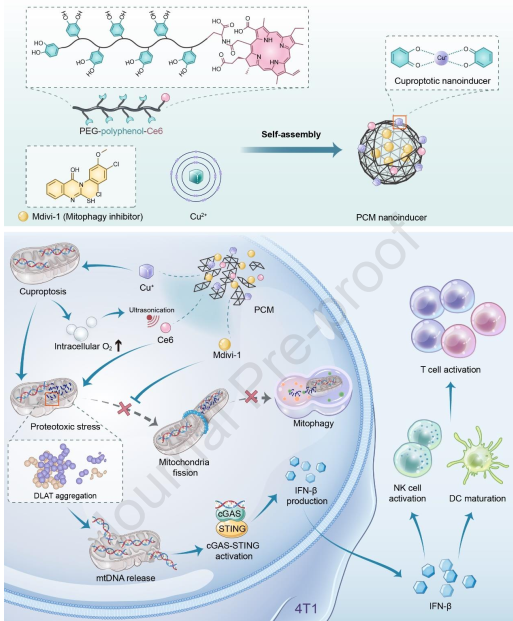
蛋白毒性應激是由異常未折疊或錯誤折疊的細胞蛋白積累引起的,可有效激活炎癥性固有免疫反應。啟動線粒體蛋白毒性應激可以使線粒體內的DNA(mtDNA)在胞內釋放,從而激活與免疫相關的mtDNA-cGAS-STING。然而,這一過程往往會很容易被細胞的自保護機制(即線粒體自噬)所消除。有鑒于此,澳門大學代云路教授和李蓓教授構建了一種納米誘導劑(PCM),其可以觸發線粒體自噬抑制的銅死亡蛋白毒性。
本文要點:
(1)通過簡單的金屬-酚配位,PCMs可利用具有酚基的PEG-多酚-Ce6將Cu2+還原為Cu+。Cu+對二氫硫辛酰胺S-乙酰基轉移酶(DLAT)具有較高的親和力,并且能夠聚集DLAT以實現銅死亡蛋白毒性應激和線粒體呼吸抑制。與此同時,與PCMs偶聯的Ce6可利用呼吸抑制所節省的細胞內氧氣來增強蛋白毒性應激。
(2)此外,PCMs負載的線粒體自噬抑制劑(Mdivi-1)也可以防止蛋白毒性產物被線粒體自噬清除,從而使更多的mtDNA釋放到細胞質中,以成功激活cGAS-STING信號通路。體內外研究結果表明,PCMs可使腫瘤浸潤的NK細胞上調24%,并增強效應T細胞的細胞毒性殺傷作用。綜上所述,該研究開發了一種通過誘導線粒體蛋白毒性增強抗腫瘤免疫治療的新方法。
Xinying Yu. et al. Cuproptotic nanoinducer-driven proteotoxic stress potentiates cancer immunotherapy by activating the mtDNA–cGAS–STING signaling. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224000462



















