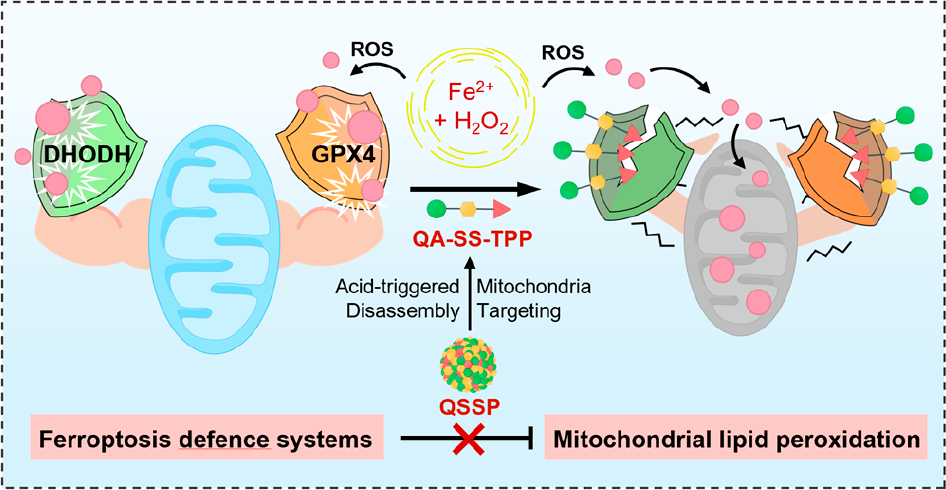
鐵死亡是一種具有鐵依賴性、由脂質活性氧(ROS)積累所導致的一種調節性細胞死亡形式。然而,腫瘤鐵死亡的效率仍會受到細胞內的鐵死亡防御系統、谷胱甘肽過氧化物酶4(GPX4)系統和泛素系統(CoQH2)等因素的嚴重限制。受線粒體在鐵死亡過程中的關鍵作用的啟發,廈門大學朱鉉教授和霍帥東教授開發了一種能夠實現強效的線粒體脂質過氧化和細胞鐵死亡的前藥納米組裝體。
本文要點:
(1)實驗通過含二硫的連接體將二氫乳清酸脫氫酶(DHODH)抑制劑(QA)與三苯基鏻部分進行結合,從而在單分子框架內構建了具有明確定義的納米組裝體(QSSP)。研究發現,癌細胞內的酸性條件會導致QSSP發生結構分解,從而釋放出游離的前藥分子。線粒體膜電位驅動的親脂性陽離子前藥積累會被遞送到線粒體。
(2)隨后,硫醇-二硫鍵交換將會導致還原型谷胱甘肽水平的下調,從而使得定位于線粒體的GPX4失活,以誘導鐵死亡的發生。與此同時,由相鄰酯鍵發生水解反應所釋放的QA可以進一步破壞線粒體防御,并通過DHODH-CoQH2系統引起顯著的鐵死亡。綜上所述,該研究構建的亞細胞靶向納米組裝體有望為通過干擾抗鐵死亡系統以實現基于鐵死亡的有效癌癥治療提供一個新的策略。
Nian Liu. et al. Mitochondria-Targeted Prodrug Nanoassemblies for Efficient Ferroptosis-Based Therapy via Devastating Ferroptosis Defense Systems. ACS Nano. 2024
DOI: 10.1021/acsnano.3c10133
https://pubs.acs.org/doi/10.1021/acsnano.3c10133



















