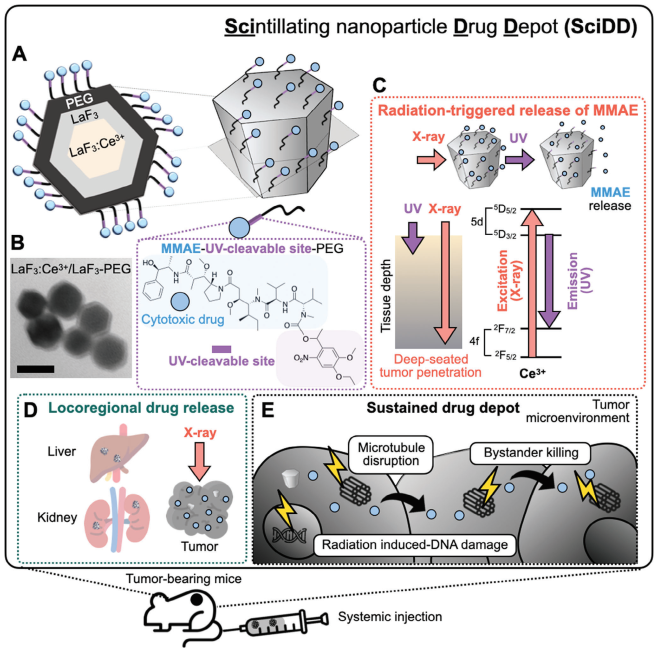
X射線放射治療(XRT)是一種重要的臨床腫瘤治療方式。開發空間精確的輻射激活給藥策略有望能夠在提高XRT療效的同時限制全身給藥造成的脫靶毒性。然而,如何實現這一目標仍是一項極具挑戰性的難題,主要原因在于目前已有的策略通常依賴于短壽命的自由基物種,而乏氧和酸性腫瘤微環境等固有特性往往也會導致空間異質性效應。有鑒于此,麻省總醫院研究所Miles A. Miller構建了能夠吸收X射線以產生發光的閃爍納米粒子,其可以在腫瘤組織中形成局部治療藥物庫。
本文要點:
(1)該納米粒子平臺(閃爍納米粒子藥物庫,SciDD)僅在被XRT激活后才會局部釋放具有細胞毒性的有效載荷,從而可以避免產生脫靶毒性。為了進行概念驗證,研究者將SciDD用于遞送有效載荷,即微管去穩定劑MMAE(一甲基澳瑞他汀E)。研究發現,只需對腫瘤進行低至2 Gy的局部照射就可以實現MMAE的釋放,從而能夠有效地殺傷腫瘤細胞。
(2)研究者也進一步在多種小鼠腫瘤模型中對XRT介導的藥物釋放行為進行了探究,并證明了其能夠表現出比單純XRT更為顯著的療效(p < 0.0001)。綜上所述,該研究構建的SciDD可以作為一種能夠時空控制癌癥治療藥物釋放的局部藥物庫。
Mikyung Kang. et al. Sustained and Localized Drug Depot Release Using Radiation-Activated Scintillating Nanoparticles. Advanced Materials. 2024
DOI: 10.1002/adma.202312326
https://onlinelibrary.wiley.com/doi/10.1002/adma.202312326



















