放療是一種被廣泛應用于治療食管鱗狀細胞癌(ESCC)的重要策略,但其療效仍會受到腫瘤組織的放射抗性和正常組織的不良反應等問題的影響。有鑒于此,中國醫學科學院北京協和醫學院劉芝華教授、駱愛萍研究員、國家納米科學中心趙宇亮院士、陳春英院士和劉晶研究員基于環磷酸腺苷-腺苷酸合成酶-干擾素刺激基因(cGAS-STING)通路的4個核心基因構建了用于預測預后和評估免疫細胞浸潤的標志,證明了cGAS-STING通路與ESCC的放療療效密切相關。
本文要點:
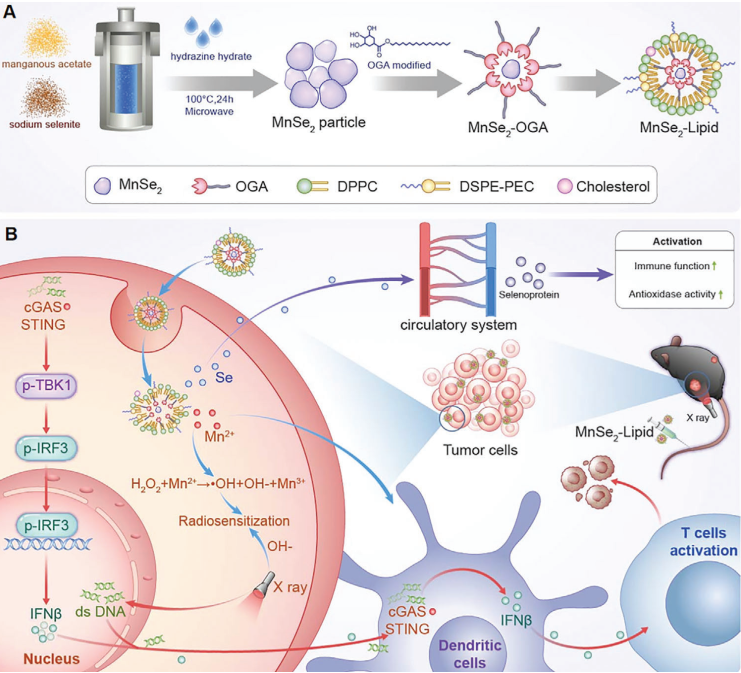
(1)實驗制備了一種脂質修飾的新型雙硒化錳納米顆粒(MnSe2-lipid),其具有非常均勻的球形形態和對腫瘤微環境(TME)的響應性,能夠同時克服輻射抵抗和減少輻射不良反應。研究發現,均勻的MnSe2-lipid可在腫瘤內實現有效的積累。沒食子酸十八烷基酯在MnSe2表面形成的pH響應型金屬-酚共價結構可在TME中發生快速降解。
(2)與此同時,釋放的Mn2+可通過誘導類芬頓反應產生活性氧,并激活cGAS-STING通路,以增強腫瘤對放療的敏感性。硒可通過促進細胞因子分泌和增加白細胞來增強免疫應答,并發揮抗氧化作用,以減少放療產生的不良反應。綜上所述,該研究設計的TME響應型多功能治療藥物可通過cGAS-STING通路介導的免疫刺激和化學動力學治療實現腫瘤放療增敏,并可對正常組織進行輻射防護,從而能夠進一步優化對ESCC的治療效果。
Xinyue Li. et al. Octadecyl Gallate and Lipid-Modified MnSe2 Nanoparticles Enhance Radiosensitivity in Esophageal Squamous Cell Carcinoma and Promote Radioprotection in Normal Tissues. Advanced Materials. 2024
DOI: 10.1002/adma.202311291
https://onlinelibrary.wiley.com/doi/10.1002/adma.202311291



















