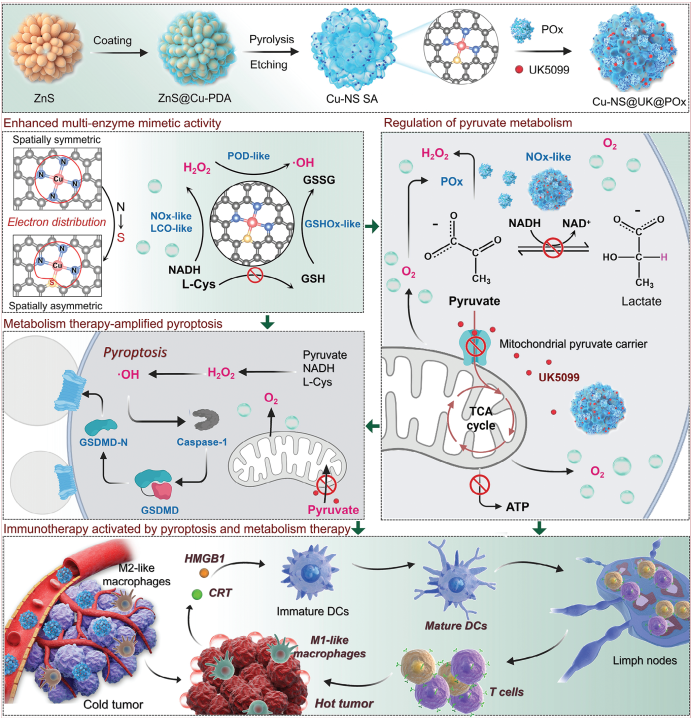
提高細胞免疫原性和重塑免疫腫瘤微環境(TME)是實現抗腫瘤免疫治療的關鍵。有鑒于此,中國科學院長春應化所張洪杰院士、王櫻蕙研究員和Yang Liu開發了一種新型的單原子納米酶焦亡誘導劑,即共負載UK5099和丙酮酸氧化酶(POx)的Cu-NS單原子納米酶(Cu-NS@UK@POx),其不僅可通過級聯生物催化觸發焦亡以增強腫瘤細胞的免疫原性,而且能夠通過靶向丙酮酸代謝來重塑免疫抑制性TME。
本文要點:
(1)實驗通過利用電負性弱的S取代N,改變了Cu-N4電子分布的原有空間對稱性,從而實現了對酶催化過程的有效調控。與空間對稱的Cu-N4單原子納米酶(Cu-N4 SA)相比,空間不對稱的S摻雜單原子納米酶(Cu-NS SA)具有更強的氧化酶活性,包括過氧化物酶(POD)、煙酰胺腺嘌呤二核苷酸(NADH)氧化酶(NOx)、L-半胱氨酸氧化酶(LCO)和谷胱甘肽氧化酶(GSHOx)等,因此其可以誘導產生活性氧(ROS)風暴以觸發細胞焦亡。
(2)此外,Cu-NS SA、UK5099和POx的協同作用也可以靶向丙酮酸代謝,從而不僅能夠改善免疫TME,也可以增加細胞焦亡的程度。實驗結果表明,該研究設計的“雙管齊下”治療策略可通過誘導ROS風暴、消耗NADH/谷胱甘肽/L-半胱氨酸、丙酮酸氧化和乳酸(LA)/ATP耗竭等機制觸發細胞焦亡和實現代謝調節,從而顯著激活抗腫瘤免疫治療。綜上所述,該研究工作構建的納米藥物在增強抗腫瘤免疫治療方面具有廣闊的應用前景。
Rui Niu. et al. Programmed Targeting Pyruvate Metabolism Therapy Amplified Single-Atom Nanozyme-Activated Pyroptosis for Immunotherapy. Advanced Materials. 2024
DOI: 10.1002/adma.202312124
https://onlinelibrary.wiley.com/doi/10.1002/adma.202312124




















