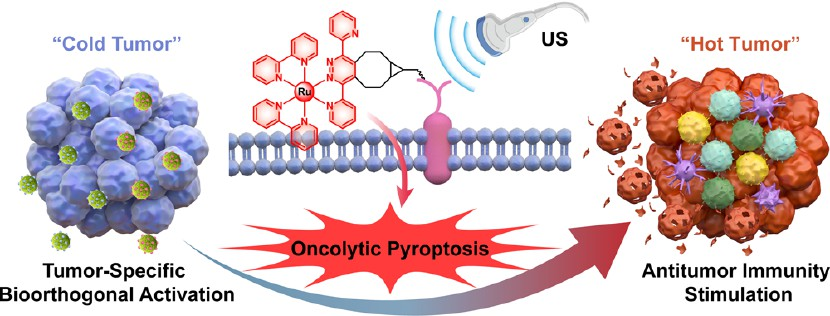
個性化原位腫瘤疫苗是一種極具發展前景的免疫治療方法。然而,利用免疫原性細胞死亡(ICD)來制備原位腫瘤疫苗的策略仍會受到免疫原性不足和免疫抑制性腫瘤微環境(TME)等問題的影響。有鑒于此,中國科學院深圳先進技術研究院蔡林濤研究員、李文軍研究員和深圳技術大學設計潘正銀教授設計并篩選了一系列四嗪功能化的釕(II)聲敏劑,并將其用于通過誘導溶瘤細胞焦亡來建立生物正交激活的原位腫瘤疫苗。
本文要點:
(1)基于納米遞送增強的生物正交糖代謝工程能夠對腫瘤進行選擇性重塑,進而將人工靶點雙環[6.1.0]壬炔(BCN)引入細胞膜中。通過與腫瘤內的BCN受體發生特異性生物正交連接,該聲敏劑可以在腫瘤部位實現精準的膜錨定和同步點擊激活。在超聲的激發作用下,活化的聲敏劑能夠通過產生I/II型活性氧(ROS)以顯著破壞細胞膜,從而實現高效的聲動力治療(SDT)。
(2)實驗結果表明,嚴重的膜損傷可顯著誘導溶瘤性細胞焦亡,以實現腫瘤免疫原性的最大化,并逆轉免疫抑制性TME,從而產生強大且持久的全身抗腫瘤免疫應答。在"冷"腫瘤模型中,US誘導的細胞焦亡可以有效抑制原發和遠端腫瘤的生長,并抑制腫瘤的轉移和復發。綜上所述,該研究設計的由生物正交驅動的腫瘤特異性焦亡誘導策略在開發強效的原位腫瘤疫苗方面具有廣闊的應用前景。
Xiaoyu Xu. et al. Bioorthogonal/Ultrasound Activated Oncolytic Pyroptosis Amplifies In Situ Tumor Vaccination for Boosting Antitumor Immunity. ACS Nano. 2024
DOI: 10.1021/acsnano.3c11023
https://pubs.acs.org/doi/10.1021/acsnano.3c11023



















