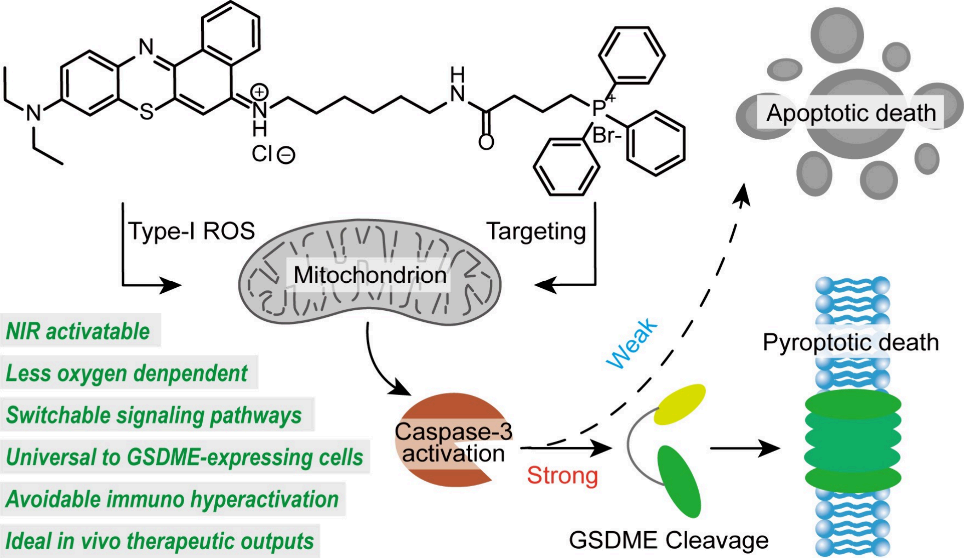
在程序性細胞死亡過程中精確地控制細胞信號事件具有重要的意義,也是癌癥治療面臨的一項嚴峻挑戰。由于缺乏高效、生物相容性和時空可控的方法,因此如何對腫瘤細胞中的信號轉導進行調控仍是一個亟待攻克的難題。有鑒于此,新加坡國立大學劉小鋼教授、復旦大學步文博教授和香港城市大學李振聲教授設計了一種光動力策略,其可通過改變caspase-3蛋白活性和相關的信號交流來調節凋亡型和焦亡型細胞死亡。
本文要點:
(1)該策略采用了靶向線粒體的近紅外激活探針(M-TOP),該探針可通過I型光化學機制發揮作用。M-TOP對氧的依賴性較低,其即使在乏氧的條件下也能有效地治療耐藥癌細胞。研究發現,較高劑量的M-TOP可通過caspase-3/gasdermin-E通路誘導焦亡型細胞死亡,而較低劑量的M-TOP則會導致細胞凋亡。
(2)這種光動力治療策略對多種表達gasdermin-E的癌細胞有效。實驗結果表明,M-TOP介導的從凋亡到焦亡調節的轉變能夠引起可控的炎癥反應,進而產生強效且平衡的免疫應答,以有效地抑制遠端腫瘤的生長和術后腫瘤的復發。綜上所述,該研究工作證明了通過合理設計光動力抗癌藥物能夠實現對細胞內信號的有效調節。
Zhigao Yi. et al. Mitochondria-Targeting Type?I Photodrug: Harnessing Caspase?3 Activity for Pyroptotic Oncotherapy. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c01929
https://pubs.acs.org/doi/10.1021/jacs.4c01929



















