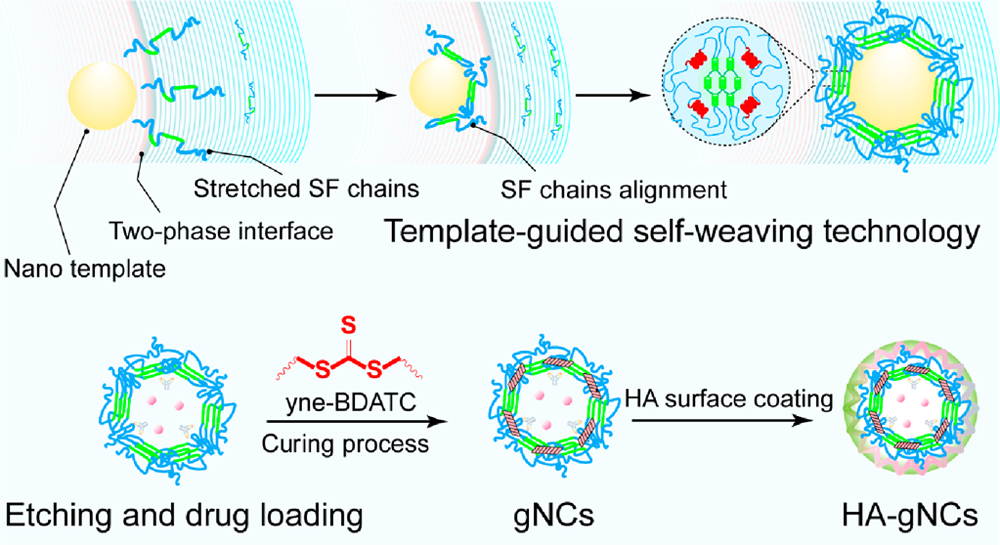
理想的藥物載體應具有較高的載藥量和包封率以及精準的藥物靶向釋放等性能。有鑒于此,重慶大學蔡開勇教授、馮茜教授和中國科學院大學重慶學院于永生研究員基于模板引導的反向微乳液(RME)相分離絲素蛋白(SF)自編織技術,制備了一種透明質酸(HA)包被的SF納米籠(HA-gNCs),并將其用于遞送腫瘤免疫治療藥物。
本文要點:
(1)HA-gNCs具有中空結構,可同時高效地包封抗炎藥物磷酸倍他米松(BetP)和免疫檢查點阻斷劑(ICB)PD-L1抗體(αPD-L1)。研究發現,用于加強HA-gNCs的SF外殼的硫代碳酸酯交聯劑可以被過表達的谷胱甘肽(GSH)快速破壞,從而能夠在腫瘤組織內實現藥物的快速釋放,并產生硫化氫(H2S)。
(2)實驗結果表明,釋放的BetP和產生的H2S的協同作用能夠對免疫抑制性腫瘤微環境(ITME)進行時序調節,從而增強αPD-L1對腫瘤生長、轉移和復發的治療作用。綜上所述,該研究構建的HA-gNCs在作為癌癥藥物遞送平臺方面具有廣闊的應用前景。
Shuangquan Gou. et al. Glutathione-Responsive and Hydrogen Sulfide Self-Generating Nanocages Based on Self-Weaving Technology To Optimize Cancer Immunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.3c08939
https://pubs.acs.org/doi/10.1021/acsnano.3c08939



















