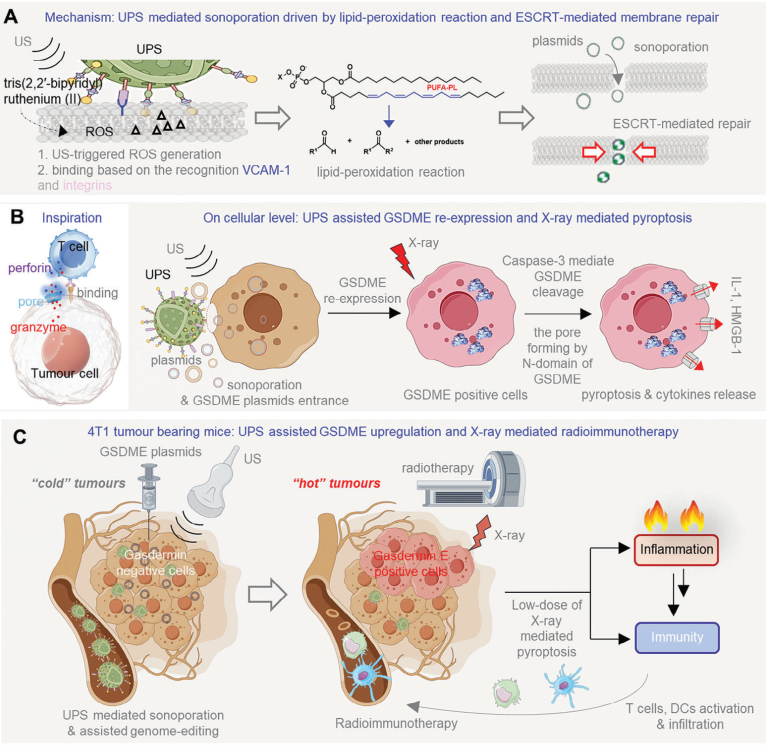
基因組編輯策略有望能夠改善抗腫瘤免疫治療的效果。然而,細胞質膜會阻止幾乎所有的游離基因組調控制劑的進入。因此,研究者亟需開發一種時空可控、并且能夠立即打開細胞膜的系統,從而使得基因組編輯制劑可以進入靶細胞。受T細胞可通過穿孔將細胞毒素遞送至癌細胞的能力啟發,溫州醫科大學王欽陽研究員開發了一種超聲(US)控制的穿孔系統(UPS),以增強對游離的基因組調控藥物的遞送。
本文要點:
(1)UPS可以穿透腫瘤細胞膜,并同時能夠通過可控的脂質過氧化反應維持細胞的活力。在體外,無跨膜功能的質粒可以在UPS的輔助下進入細胞并進行基因組編輯,效率高達90%。在體內,具有可生物降解性、非免疫原性和腫瘤靶向性的UPS能夠在超聲作用下實現腫瘤細胞穿孔。
(2)實驗結果表明,UPS輔助的基因組編輯技術可成功恢復4T1荷瘤小鼠體內的gasdermin-E的表達,從而能夠在低劑量X射線的照射下實現焦亡介導的抗腫瘤免疫治療。綜上所述,該研究能夠為設計用于基因組編輯的聲孔系統提供新的見解,并進一步證明了利用基因組編輯技術恢復gasdermin的表達可顯著提高放射免疫治療的療效。
Hao Yin. et al. A T-Cell Inspired Sonoporation System Enhances Low-Dose X-Ray-Mediated Pyroptosis and Radioimmunotherapy Efficacy by Restoring Gasdermin-E Expression. Advanced Materials. 2024
DOI: 10.1002/adma.202401384
https://onlinelibrary.wiley.com/doi/10.1002/adma.202401384



















