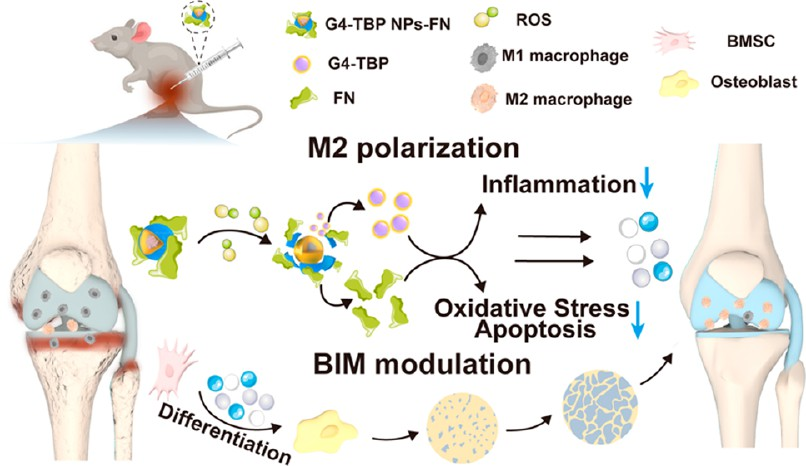
納米藥物能夠協同清除活性氧(ROS)和抑制炎癥細胞因子,并促進骨生成,因此有望實現對骨關節炎(OA)的有效治療。有鑒于此,東華大學史向陽教授設計了一種基于纖連蛋白(FN)包覆、負載磷樹狀大分子(G4-TBP)的聚合物納米粒子(NPs)的ROS響應性納米藥物制劑。
本文要點:
(1)實驗構建的G4-TBP NPs-FN的大小約為268 nm,其在生理條件下具有良好的穩定性,可通過FN介導的靶向作用被巨噬細胞特異性攝取,并且能夠在氧化的炎癥微環境中發生解離。研究發現,負載了具有抗炎特性的G4-TBP樹狀大分子和具有抗炎、抗氧化特性的FN的G4-TBP NPs-FN同時集成了活性氧清除、乏氧緩解和巨噬細胞M2極化等功能,從而能夠保護巨噬細胞免受凋亡,并且可以為干細胞的成骨分化創造有利的骨免疫微環境。
(2)實驗結果表明,G4-TBP NPs-FN可在體內實現對OA的有效治療,減少關節的病理變化(包括滑膜炎抑制和軟骨基質降解),并同時促進成骨分化,以實現骨修復。綜上所述,該研究構建的納米藥物制劑充分結合了具有生物活性的磷樹狀大分子和FN在OA治療方面的優勢,有望實現對不同炎癥性疾病的免疫調節治療。
Mengsi Zhan. et al. Nanoparticle-Mediated Multiple Modulation of Bone Microenvironment To Tackle Osteoarthritis. ACS Nano. 2024
DOI: 10.1021/acsnano.4c00909
https://pubs.acs.org/doi/10.1021/acsnano.4c00909



















