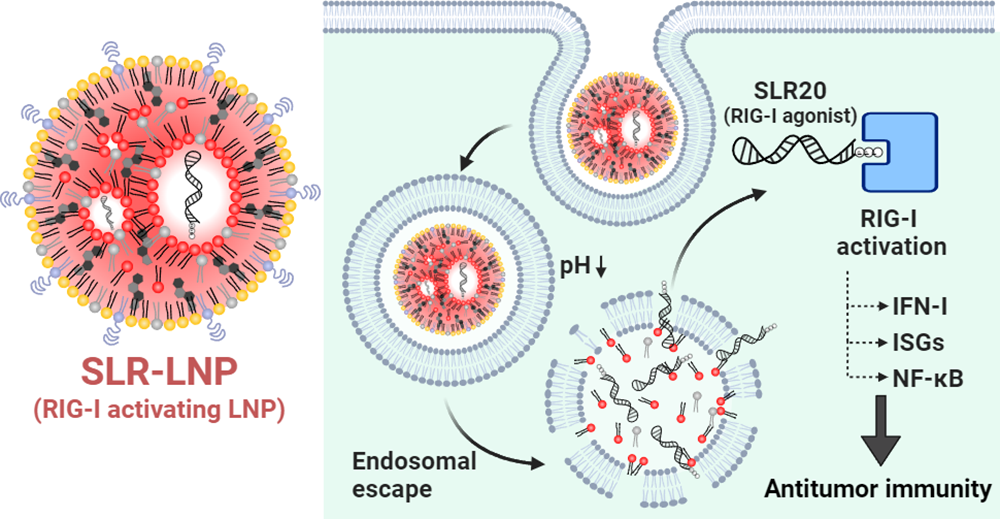
藥理性激活維甲酸誘導基因I(RIG-I)通路有望能夠提高腫瘤的免疫原性,并改善免疫檢查點抑制劑(ICIs)產(chǎn)生的免疫應答。然而,RIG-I的5'-三磷酸RNA(3pRNA)激動劑的臨床療效仍會受到多種藥理學障礙(藥代動力學差、核酸酶降解以及無法被有效遞送到RIG-I所在的細胞質中)的影響。有鑒于此,范德堡大學John T. Wilson通過利用可電離脂質納米顆粒(LNPs)遞送3p修飾的莖-環(huán)RNA(SLRs)來解決上述問題。
本文要點:
(1)實驗通過將SLRs封裝進LNPs構建了粒徑約為100納米、表面電荷中性的納米顆粒SLR-LNPs,其可在體內(nèi)外有效激活RIG-I信號通路。研究發(fā)現(xiàn),通過瘤內(nèi)注射和靜脈注射等途徑給藥的SLR-LNPs可在腫瘤微環(huán)境(TME)中激活RIG-I,并且能夠在免疫原性較差的黑色素瘤和乳腺癌小鼠模型中抑制腫瘤的生長。
(2)在原位三陰性乳腺癌EO771模型中,全身給藥的SLR-LNPs可重編程乳腺癌TME,以增強具有抗腫瘤功能的CD8+和CD4+ T細胞的浸潤,改善αPD-1 ICI誘導的免疫反應。研究者也在轉移性B16模型中進一步證實了SLR-LNPs的治療效果。在F10黑色素瘤模型中,與αPD-1 + αCTLA-4聯(lián)合ICI相比,全身給藥的SLR-LNPs可顯著降低肺轉移負荷。綜上所述,該研究構建的SLR-LNPs是一種具有轉化前景的免疫治療納米藥物,可有效、選擇性地激活RIG-I,從而能夠增強ICI和其他免疫治療模式誘導的抗腫瘤免疫應答。
Lihong Wang-Bishop. et al. Nanoparticle Retinoic Acid-Inducible Gene I Agonist for Cancer Immunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.3c06225
https://pubs.acs.org/doi/10.1021/acsnano.3c06225



















