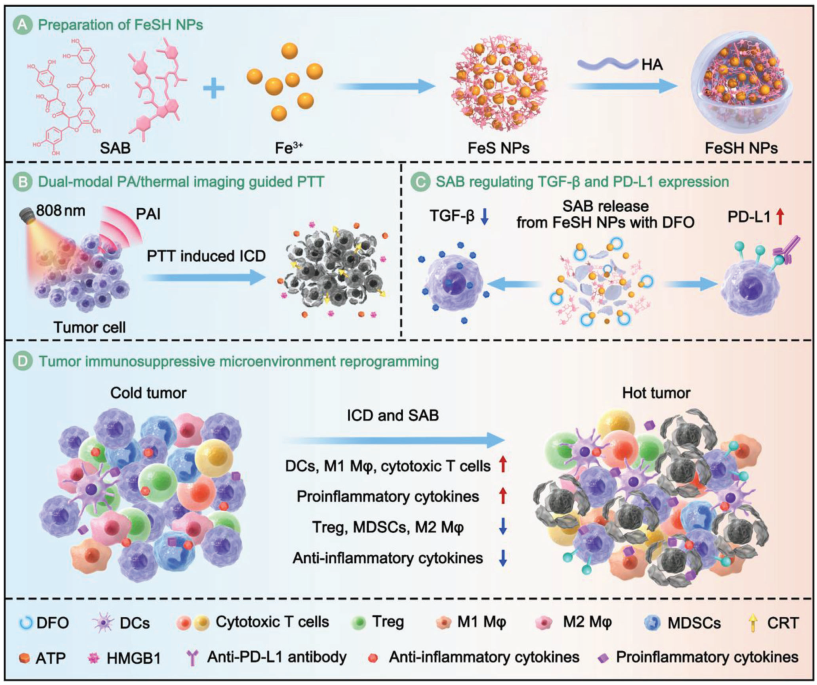
三陰性乳腺癌(TNBC)是一種免疫“冷”腫瘤。現有的單藥治療方法往往難以完全消除TNBC,并且無法抑制其復發和轉移。因此,研究者需要對多種療法的組合進行合理設計,以程序化重建腫瘤微環境(TME),將免疫"冷"腫瘤逆轉為"熱"炎癥腫瘤,從而提高治療效果。有鑒于此,廈門大學田華雨教授和Kai Hao將金屬-多酚配位復合物作為光熱制劑,將多酚和丹酚酸B(SAB)作為免疫調節劑,設計并制備了一種多功能納米體系(FeSH NPs),以實現聯合抗PD-L1抗體的協同光熱-免疫TNBC治療。
本文要點:
(1)在光熱/光聲雙模態成像的引導下,FeSH NPs能夠在808 nm激光的照射下通過光熱治療(PTT)誘導免疫原性細胞死亡(ICD)。隨后,負載的SAB會隨著甲磺酸去鐵胺(DFO)的加入而被釋放,以重塑TME(抑制TGF-β和上調PD-L1),進而消除原發腫瘤。研究發現,FeSH NPs可通過PTT和TME重編程等策略實現與抗PD-L1抗體的協同效應,從而抑制TNBC的復發與轉移。
(2)實驗結果表明,FeSH NPs具有良好的生物安全性。綜上所述,該研究能夠為實現對免疫“冷”腫瘤TNBC的綜合程序化治療提供一個具有較高臨床轉化潛力的新方案。
Meng Meng. et al. A Comprehensive Strategy Based on High Clinical Translational Nanosystem for Programmable Immunotherapy of Triple Negative Breast Cancer. Advanced Materials. 2024
DOI: 10.1002/adma.202314309
https://onlinelibrary.wiley.com/doi/10.1002/adma.202314309



















