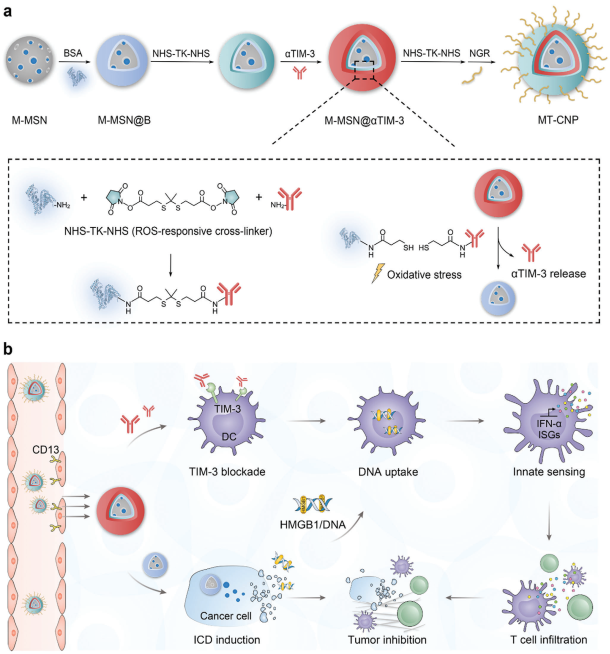
治療誘導的免疫原性細胞死亡(ICD)會啟動先天和適應性免疫應答,以增強抗腫瘤療效。然而,死亡細胞釋放的ICD信號往往會被樹突狀細胞(DC)表面的TIM-3受體所隔離,從而阻礙免疫監視。有鑒于此,上海交通大學季曉媛研究員、宋海云研究員和上海師范大學陳楠教授制備了可拆卸的冠層納米顆粒(NPs),并將其作為一種時空可控的納米載體以耦合腫瘤細胞介導的ICD誘導和DC介導的免疫感知。
本文要點:
(1)該納米粒子負載了ICD誘導劑米托蒽醌(MTO),并被對氧化還原不穩定的抗TIM-3(αTIM-3)抗體冠層包裹,具有可分離的核殼結構。在腫瘤微環境中,抗體冠層會在高水平的胞外活性氧作用下發生降解,以暴露負載MTO的NP內核,從而誘導ICD,并釋放功能性αTIM-3分子,實現DC敏化。
(2)全身給藥后,冠層修飾的NPs可促進DC成熟,增強細胞毒性T細胞募集,提高腫瘤對免疫檢查點阻斷的敏感性,并且可以有效預防MTO的副作用。綜上所述,該研究開發的新型納米平臺可充分利用宿主免疫以實現癌癥治療。
Huan Liang. et al. Dismantlable Coronated Nanoparticles for Coupling the Induction and Perception of Immunogenic Cell Death. Advanced Materials. 2024
DOI: 10.1002/adma.202313097
https://onlinelibrary.wiley.com/doi/10.1002/adma.202313097



















