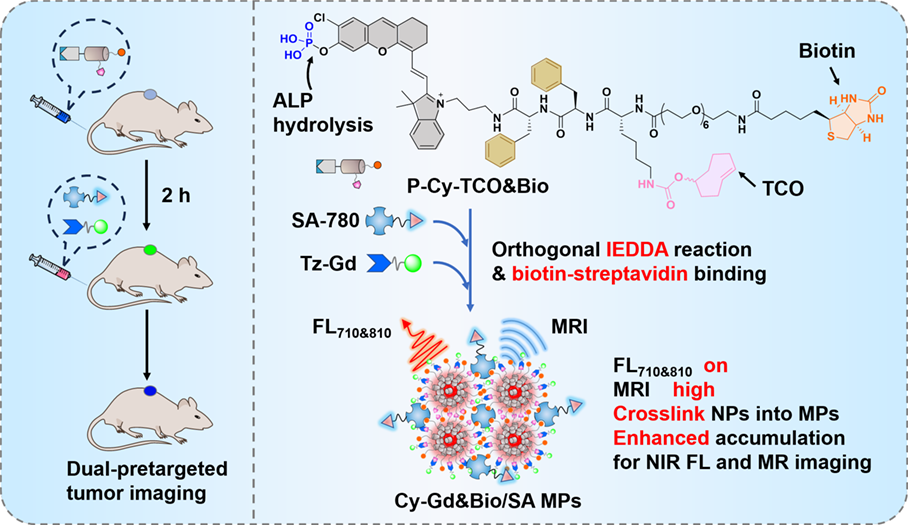
將靶向載體與放射性核素進行解耦的預靶向策略在體內核醫學成像與治療領域中表現出了廣闊的應用前景。然而,目前的預靶向方法大多需要將抗體或納米顆粒作為靶向載體,因此會受到組織穿透性差以及靶向載體在腫瘤組織中的積累有限等問題的影響。有鑒于此,南京大學葉德舉教授設計了一種正交的雙重預靶向方法,將刺激觸發的原位自組裝策略與快速的逆電子需求Diels-Alder(IEDDA)反應和生物素-鏈霉親和素(SA)之間的強相互作用進行結合,以實現對腫瘤的近紅外熒光(NIR FL)和磁共振(MR)成像。
本文要點:
(1)該方法將含有生物素和反式環辛烯(TCO)的小分子探針(P-Cy-TCO&Bio)作為腫瘤靶向載體。P-Cy-TCO&Bio可通過生物素輔助的靶向遞送有效地穿透皮下HeLa腫瘤,并在腫瘤細胞膜上進行原位自組裝以形成生物素化的TCO納米粒子(Cy-TCO&Bio NPs)。研究發現,Cy-TCO&Bio NPs具有“off-on”的近紅外熒光,并且能夠保留在腫瘤中以提供高密度的TCO和生物素基團,進而可通過正交IEDDA反應和SA-生物素相互作用同時捕獲Gd螯合物標記的四嗪(Tz-Gd)和IR780標記的SA(SA-780)。
(2)Cy-TCO&Bio NPs具有對SA的多價結合模式,能夠進一步調節Cy-Gd&Bio NPs的交聯以形成微粒(Cy-Gd&Bio/SA MPs)。實驗結果表明,該過程能夠顯著提高r1弛豫率,并增強Tz-Gd和SA-780在腫瘤內的積累,進而產生較強的近紅外熒光(NIR FL)和MR對比度以及延長的時間窗,從而能夠實現對HeLa腫瘤的精準成像。
Jianhui Weng. et al. Controlled In Situ Self-Assembly of Biotinylated Trans-Cyclooctene Nanoparticles for Orthogonal Dual-Pretargeted Near-Infrared Fluorescence and Magnetic Resonance Imaging. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c00731
https://pubs.acs.org/doi/10.1021/jacs.4c00731



















