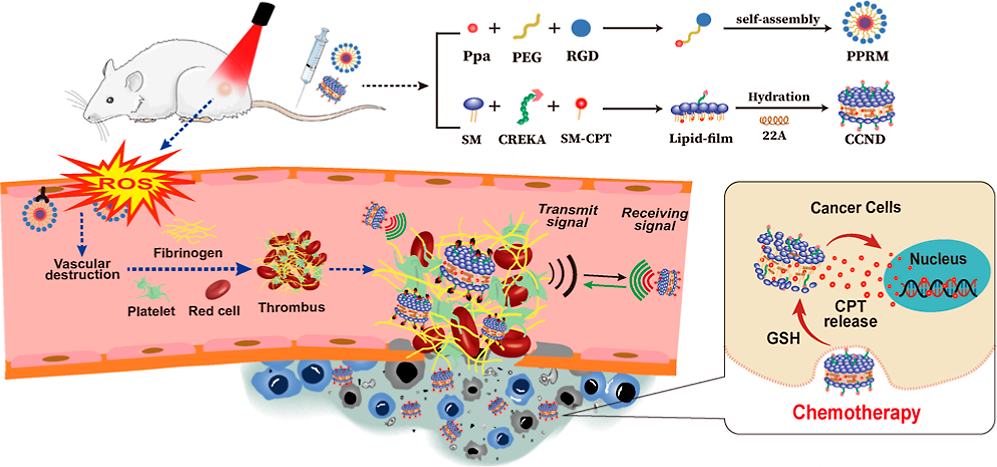
如何實現腫瘤靶向藥物的高效遞送是目前腫瘤化療面臨的一項嚴峻挑戰。由于腫瘤具有異質性,因此基于被動或主動靶向策略的納米藥物在臨床上尚未取得令人滿意的化療效果。受急性凝血塊對炎癥細胞的有效募集作用的啟發,首都醫科大學錢林學教授、北京大學戴志飛教授和劉仁發博士構建了一種雙組分納米系統,該系統包含RGD修飾的焦磷酸-a(Ppa)膠束(PPRM),其可通過介導靶向腫瘤血管的光動力反應來激活局部凝血,并隨后將凝血信號傳遞給靶向循環血塊、CREKA肽修飾、負載喜樹堿(CPT)的納米盤(CCNDs),以增強其腫瘤靶向性。
本文要點:
(1)PPRM可有效結合腫瘤血管,并且能夠通過光動力反應誘導產生局部血栓。研究發現,局部光動力反應誘導的腫瘤靶點擴增會使CCND在4T1乳腺腫瘤模型中的腫瘤積累顯著增加4.2倍,從而可以有效提高化療的療效。
(2)綜上所述,該研究設計了一種能夠利用PPRM激活的凝血級聯和凝血靶向CCND之間的高效交互作用以增強腫瘤特異性藥物遞送的新平臺。
Peipei Yang. et al. Photodynamically Tumor Vessel Destruction Amplified Tumor Targeting of Nanoparticles for Efficient Chemotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c00833
https://pubs.acs.org/doi/10.1021/acsnano.4c00833




















