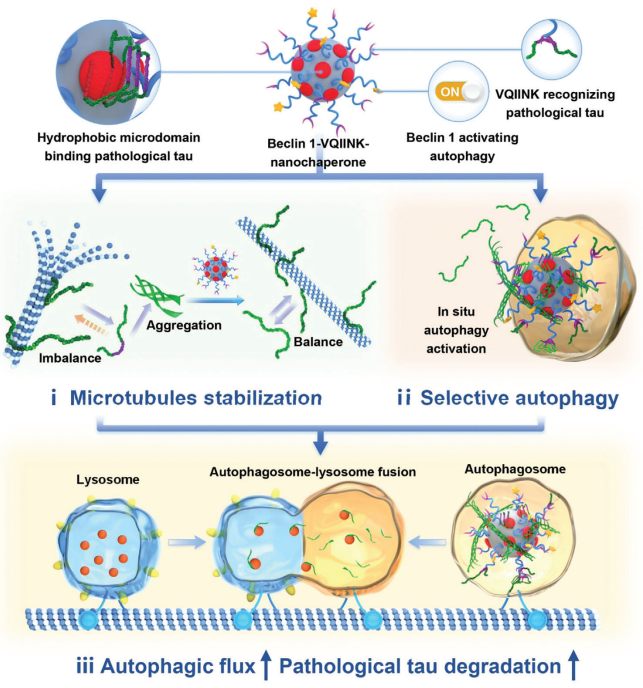
病理性tau蛋白的累積是阿爾茨海默病(AD)的一個(gè)重要標(biāo)志,與淀粉樣蛋白β(aβ)負(fù)荷相比,其與認(rèn)知損害的相關(guān)性更為密切。自噬是一種能夠清除包括異常tau蛋白在內(nèi)的毒性蛋白的有效過(guò)程。然而,包括AD在內(nèi)的神經(jīng)退行性疾病通常存在自噬受損的特征,而目前的自噬誘導(dǎo)劑也無(wú)法恢復(fù)自噬通路,并且缺乏靶向特異性。有鑒于此,南開(kāi)大學(xué)史林啟教授和中國(guó)醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院黃帆研究員構(gòu)建了基于定制納米伴侶的致病性tau特異性自噬策略,并將其用于AD治療。
本文要點(diǎn):
(1)在該策略中,納米伴侶可以選擇性結(jié)合致病性tau蛋白,并維持tau蛋白穩(wěn)態(tài),從而保證微管穩(wěn)定性(對(duì)自噬通路至關(guān)重要)。與此同時(shí),結(jié)合的致病tau蛋白也可以通過(guò)納米伴侶的原位自噬激活被隔離在自噬體中。因此,包裹著致病性tau蛋白的自噬體能夠沿著穩(wěn)定的微管進(jìn)行運(yùn)輸,從而與溶酶體發(fā)生成功融合,以增強(qiáng)自噬通量和對(duì)病理性tau蛋白的清除。
(2)實(shí)驗(yàn)結(jié)果表明,經(jīng)該納米伴侶分子介導(dǎo)的自噬策略治療后,AD小鼠大腦中的tau蛋白負(fù)荷、神經(jīng)元損傷和認(rèn)知缺陷能夠得到顯著的緩解。綜上所述,該研究為AD靶向治療提供了一個(gè)極具發(fā)展前景的新靶點(diǎn),為抗神經(jīng)退行性疾病藥物的設(shè)計(jì)開(kāi)辟了一條新的途徑。
Linlin Xu. et al. Harnessing Nanochaperone-Mediated Autophagy for Selective Clearance of Pathogenic Tau Protein in Alzheimer’s Disease. Advanced Materials. 2024
DOI: 10.1002/adma.202313869
https://onlinelibrary.wiley.com/doi/10.1002/adma.202313869



















