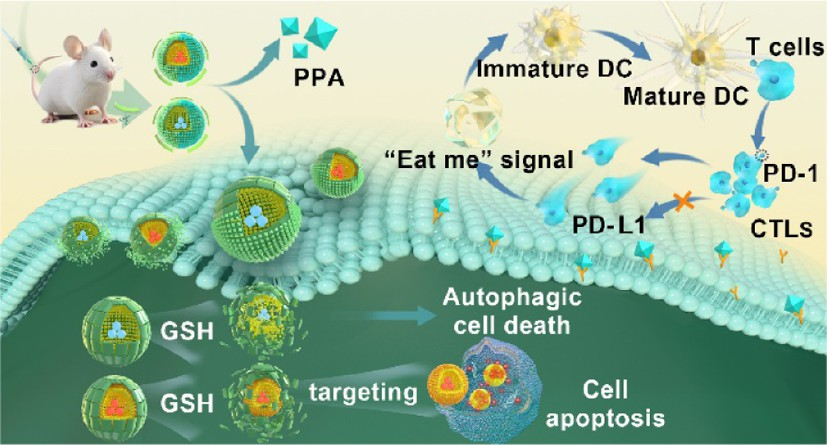
單獨使用表柔比星(EPI)會在殘留的腫瘤細胞中觸發輕度的保護性自噬,進而誘導產生免疫抑制性微環境。這不僅會加速殘余腫瘤的復發,也會導致腫瘤對抗程序性死亡配體1(anti-PD-1)/PD-L1治療耐藥,從而嚴重影響腫瘤免疫治療的臨床療效。將靶向PD-1/PD-L1通路的檢查點抑制劑和自噬放大策略進行聯合應用有望為腫瘤治療提供一條新的途徑,其能夠防止腫瘤免疫逃逸,并增強治療識別。有鑒于此,青島大學梁燕教授和四川大學樊渝江教授構建了一種氧化還原觸發、自噬誘導的PD-L1抑制納米平臺SA&EA,以增強化學免疫治療。
本文要點:
(1)透明質酸(HA)骨架和精氨酸片段能夠增強該納米平臺的靶向性、細胞攝取和穿透性。研究發現,腫瘤微環境中過表達的基質金屬蛋白酶-2(MMP-2)會切割PLGLAG肽,進而釋放PD-L1抑制劑D-PPA以抑制腫瘤免疫逃逸。此外,腫瘤細胞中的高濃度谷胱甘肽(GSH)也會通過裂解二硫鍵導致自噬誘導劑STF-62247和EPI的釋放。
(2)EPI和STF的聯合應用能夠誘導細胞凋亡和自噬性死亡,從而有效清除大部分的腫瘤細胞。實驗結果表明,SA&EA納米平臺具有比單一的STF@AHMPP組和EPI@AHMPTP組更好的治療效果。綜上所述,該研究能夠為構建氧化還原觸發、自噬誘導的PD-L1抑制納米平臺以增強化學免疫治療提供一種新的方法。
Ming Li. et al. A Redox-Triggered Autophagy-Induced Nanoplatform with PD-L1 Inhibition for Enhancing Combined Chemo-Immunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c00227
https://pubs.acs.org/doi/10.1021/acsnano.4c00227



















