有效的抗癌免疫依賴于癌細胞周期中多個階段性事件的正確激活。免疫“冷”腫瘤微環境(TME)導致免疫逃避和對傳統檢查點阻斷免疫療法的不耐受。
鑒于此, 浙江大學王杭祥、Jianqin Wan等人將納米顆粒制劑和原位形成的水凝膠支架結合起來,局部治療可觸及的腫瘤,并刺激對轉移性腫瘤病變的系統免疫。
本文要點
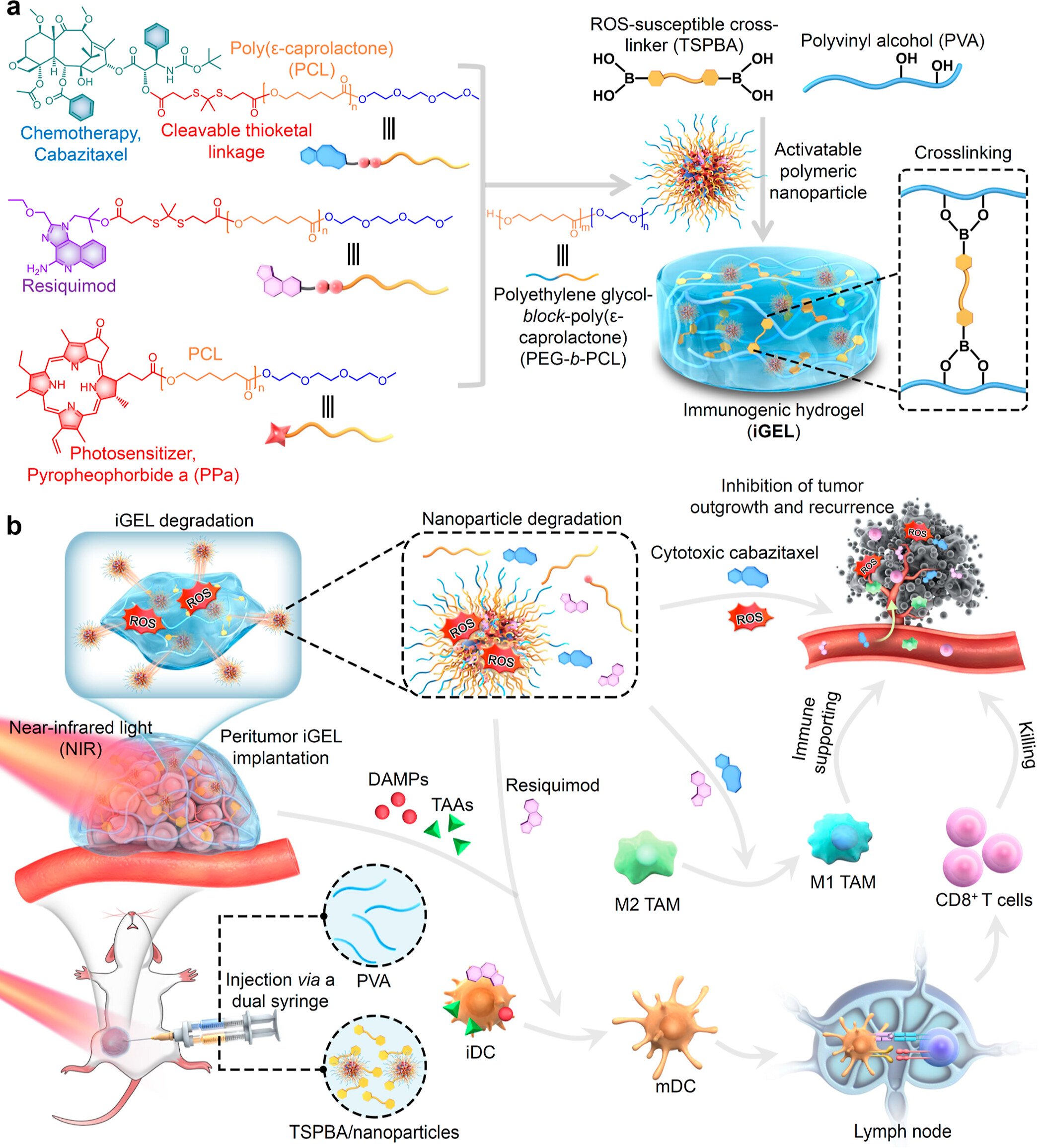
1)納米顆粒通過活性氧(ROS)可裂解的連接體包封聚(ε-己內酯)衍生的細胞毒性化療和Toll樣受體7/8的佐劑,該連接體可在近紅外(NIR)激光照射后被共組裝的相鄰光敏劑自激活。進一步的發展產生了可注射、近紅外光響應和免疫原性水凝膠(iGEL),可以在腫瘤周圍植入并沉積到腫瘤手術床中。
2)NIR激光照射后,產生的ROS誘導聚合物-藥物偶聯物中的iGEL降解和鍵斷裂,觸發癌癥細胞中的免疫原性細胞死亡級聯,并自發釋放包封劑以重新連接癌癥-免疫循環。值得注意的是,在多個黑色素瘤和癌癥三陰性臨床前模型中應用后,iGEL誘導已建立腫瘤的持久緩解,延長術后無瘤生存期,并抑制轉移負擔,這些模型對傳統免疫療法具有攻擊性和難治性。這項研究的結果是一種局部給藥的免疫原性水凝膠,用于觸發宿主的全身免疫,以提高免疫治療效果,同時將脫靶副作用降至最低。
參考文獻:
Yang Fu, et al., Syringeable Near-Infrared Light-Activated In Situ Immunogenic Hydrogel Boosts the Cancer-Immunity Cycle to Enhance Anticancer Immunity. ACS Nano 2024.
DOI: 10.1021/acsnano.3c08425
https://pubs.acs.org/doi/full/10.1021/acsnano.3c08425



















