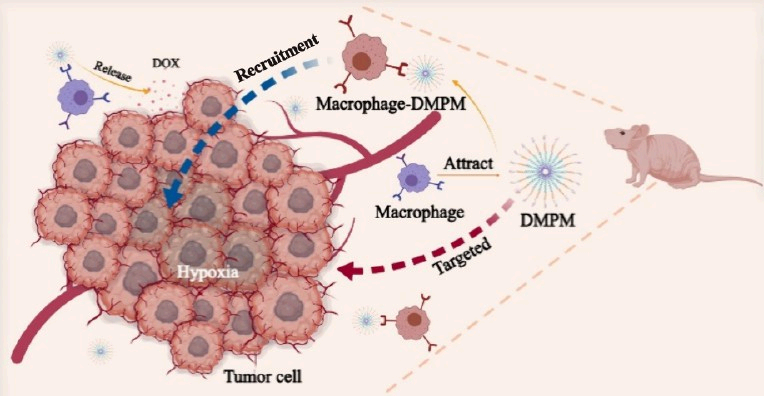
基于特定內源性細胞(如巨噬細胞)的主動靶向給藥系統具有良好的腫瘤歸巢性和生物相容性,是一種極具發展前景的腫瘤治療策略。有鑒于此,安徽工程大學朱龍寶教授和葛飛教授通過與CCR2/MCP-1軸相互作用的介導開發了在巨噬細胞(RAW264.7)表面攜帶負載多柔比星的納米粒子(DOX@MPF127-MCP-1,DMPM)的主動腫瘤靶向藥物遞送系統。
本文要點:
(1)首先,實驗將兩親性嵌段共聚物Pluronic F127(PF127)羧化為MPF127,并隨后用MCP-1多肽修飾MPF127,以制備MPF127-MCP-1(MPM)。在MPM的自組裝過程中,研究者將DOX包裹在MPM中,構建了約100 nm的DMPM納米膠束。DMPM可與巨噬細胞RAW264.7自發結合,以形成主動靶向遞送系統巨噬細胞-DMPM(macrophage-DMPM,MA-DMPM)。研究發現,MA-DMPM中的DOX能夠以對pH響應的方式在酸性腫瘤微環境(TME)中發生釋放,進而增加DOX在TME中的積累,以增強腫瘤治療效果。
(2)與對照組相比,MA-DMPM的體外歸巢率能夠達到220%,由此表明MA-DMPM具有良好的腫瘤靶向遞送性能。在非小細胞肺癌細胞(NCI-H1299)腫瘤模型中,熒光成像系統(IVIS)結果顯示MA-DMPM可在體內表現出優異的腫瘤靶向性。MA-DMPM的體內抗腫瘤作用研究表明,DMPM治療組的腫瘤細胞凋亡比例為63.33%。綜上所述,該研究構建的MA-DMPM能夠顯著抑制腫瘤細胞的生長,其在腫瘤治療領域中具有巨大的應用潛力。
Chengrui Hu. et al. Pluronic-Based Nanoparticles for Delivery of Doxorubicin to the Tumor Microenvironment by Binding to Macrophages. ACS Nano. 2024
DOI: 10.1021/acsnano.4c01120
https://pubs.acs.org/doi/10.1021/acsnano.4c01120



















