
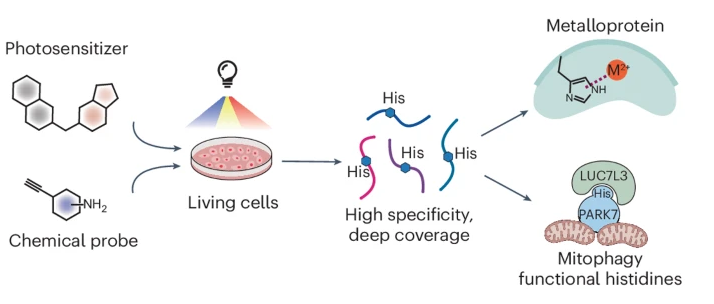
化學蛋白質組學(Chemical proteomics)近期的工作主要關注于能夠與氨基酸基團親核反應的化學探針分子。雖然人們發現組氨酸(histidine)在酶催化領域、金屬結合位點以及蛋白-蛋白相互作用、具有合適的親核性等特點,因此組氨酸是具有前景的重要結構。通常組氨酸結構的調控經常被半胱氨酸(cysteine)和賴氨酸(lysine)影響,并且導致非常差的選擇性和蛋白質組學的覆蓋非常窄。
有鑒于此,深圳灣實驗室李剛等報道單線態氧和化學探針連續標記策略,能夠高選擇性的對組氨酸進行修飾。
將這種方法應用于發現對酶催化活性以及金屬結合能力關鍵的未標記組氨酸位點。這項研究發現組氨酸能夠影響蛋白-蛋白相互作用,因此影響細胞內的蛋白位置,揭示了這種方法有助于發現功能性組氨酸位點。
參考文獻
Zhai, Y., Zhang, X., Chen, Z. et al. Global profiling of functional histidines in live cells using small-molecule photosensitizer and chemical probe relay labelling. Nat. Chem. (2024).
DOI: 10.1038/s41557-024-01545-6
https://www.nature.com/articles/s41557-024-01545-6


















