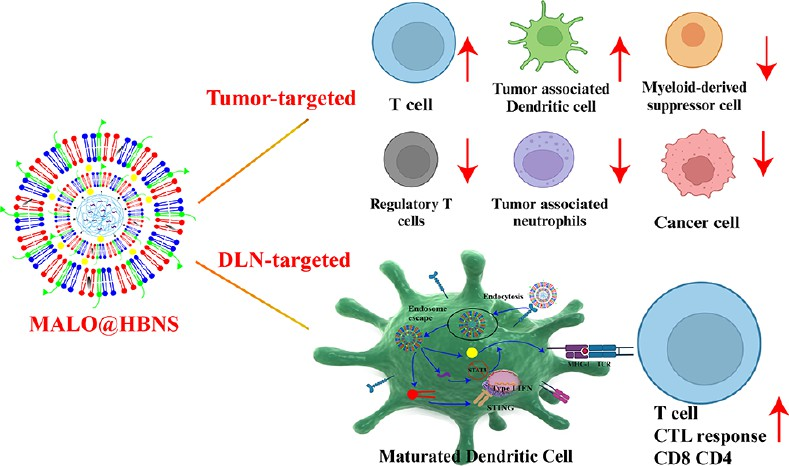
腫瘤疫苗往往會產生較低的應答率,主要原因在于其對樹突狀細胞(DC)的遞送效率低、交叉呈遞不足、DC固有的免疫抑制信號以及免疫抑制性腫瘤微環境(TME)等。有鑒于此,沈陽藥科大學唐星教授、茍靖欣教授和楊麗教授設計了靶向引流淋巴結(DLN)和腫瘤的納米疫苗,并合成了雜環類脂質(A18)和聚酯(BR647)以實現雙重靶向的癌癥免疫治療,并進一步加入寡聚透明質酸(HA)和DMG-PEG2000-甘露糖(mannose),從而制備包裹STAT3 siRNA和模型抗原的雙靶向納米疫苗。
本文要點:
(1)該納米疫苗能夠靶向DLN和腫瘤,并促進載荷進入細胞質。研究發現,雙靶向納米疫苗可以改善抗原提呈和促進DC成熟,激活干擾素基因刺激因子(STING)通路,增強促凋亡作用,并激發產生抗腫瘤免疫應答。
(2)此外,該雙靶向納米疫苗也能夠克服免疫抑制性TME,減少免疫抑制性細胞,促進腫瘤相關中性粒細胞從N2向N1極化。在4種能夠誘導產生強大的抗腫瘤應答的雙靶向納米疫苗中,雜環類脂質@聚酯雜化納米疫苗(MALO@HBNS)具有最為顯著的效果。實驗結果表明,將MALO@HBNS和抗PD-L1抗體進行聯合的策略能夠表現出非常強大的抗癌作用。綜上所述,該研究工作開發了一種用于抗腫瘤治療的雙靶向納米疫苗平臺,其具有與免疫檢查點阻斷相聯合的重要潛力。
Zixu Liu. et al. Dual-Targeted Self-Adjuvant Heterocyclic Lipidoid@Polyester Hybrid Nanovaccines for Boosting Cancer Immunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c00392
https://pubs.acs.org/doi/10.1021/acsnano.4c00392



















