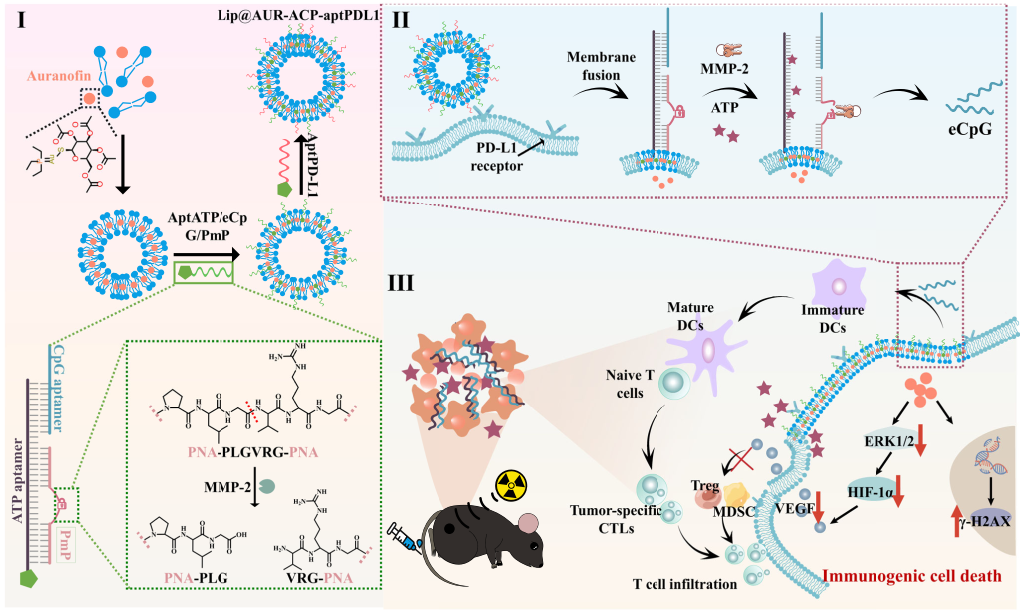
放射免疫治療能夠利用電離輻射(IR)的免疫刺激特性來增強(qiáng)抗腫瘤效應(yīng),為治療侵襲性腫瘤(如黑色素瘤)提供了新的契機(jī)。然而,IR劑量沉積不足和實(shí)體瘤的免疫抑制性微環(huán)境(TME)等因素仍會嚴(yán)重限制放射免疫治療的療效。有鑒于此,重慶大學(xué)李孟桓教授、羅忠教授和浙江大學(xué)王福俤教授開發(fā)了一種基于多功能融合脂質(zhì)體(Lip@AUR-ACP-aptPD-L1)的程序化序貫治療策略,以克服實(shí)體瘤固有的放射免疫治療抗性。
本文要點(diǎn):
(1)該融合脂質(zhì)體負(fù)載了含金的金諾芬(AUR),其脂質(zhì)膜中插入了多元門控適配體組合(ACP)和PD-L1適配體,可通過選擇性膜融合將ACP轉(zhuǎn)移到細(xì)胞表面,增強(qiáng)靶向黑色素瘤的AUR遞送。研究發(fā)現(xiàn),AUR能夠放大IR誘導(dǎo)的黑色素瘤細(xì)胞免疫原性死亡,以釋放抗原和損傷相關(guān)的分子模式(如三磷酸腺苷(ATP)),從而觸發(fā)適應(yīng)性抗腫瘤免疫。
(2)實(shí)驗(yàn)結(jié)果表明,AUR增敏的放療可以上調(diào)基質(zhì)金屬蛋白酶-2(MMP-2)的表達(dá),其能夠與釋放的ATP相聯(lián)合以通過類“和”邏輯門控操作過程(AND-gate)激活A(yù)CP,觸發(fā)工程化胞嘧啶-磷酸-鳥嘌呤適配體基免疫佐劑(eCpG)的原位釋放,進(jìn)而刺激樹突狀細(xì)胞介導(dǎo)的T細(xì)胞啟動。此外,AUR也能夠抑制腫瘤固有的血管內(nèi)皮生長因子信號通路,從而減少免疫抑制性細(xì)胞的浸潤,促進(jìn)形成抗腫瘤TME。綜上所述,該研究工作能夠?yàn)閷?shí)體瘤的臨床治療提供新的思路。
Xijiao Ren. et al. Programmable melanoma-targeted radioimmunotherapy via fusogenic liposomes functionalized with multivariate-gated aptamer assemblies. Nature Communications. 2024
https://www.nature.com/articles/s41467-024-49482-9



















