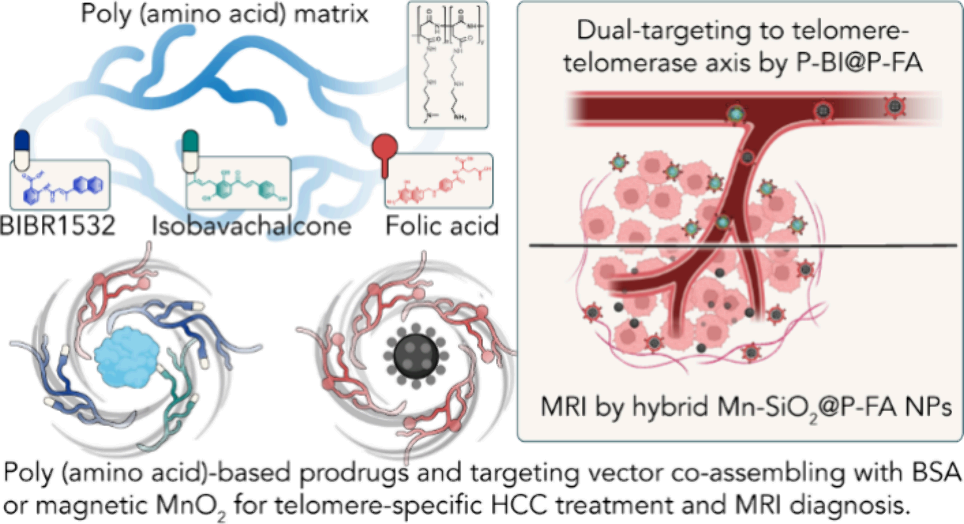
靶向端粒維持是一種用于治療肝細胞癌(HCC)的新興策略。然而,由于端粒-端粒酶軸在端粒維持中具有雙重作用,因此研究者亟需開發一種全面的靶向調控策略。有鑒于此,浙江大學余日勝教授和Hongzhen Bai設計了一種基于聚氨基酸(D-PAAs)的策略,并將其用于時空共遞送端粒酶抑制劑BIBR1523和AKT抑制劑補骨脂乙素。
本文要點:
(1)實驗通過利用D-PAAs的可修飾性合成了聚合物-抑制劑偶聯物(PB和PI)以及葉酸修飾的腫瘤靶向載體(PF)。這些構建模塊能夠利用D-PAAs的非共價組裝實現膠束化,以形成共遞送納米藥物(P-BI@P-FA)。研究發現,P-BI@P-FA可改善小分子抑制劑的藥代動力學、腫瘤選擇性和生物利用度,并且能夠通過結合端粒酶失活與端粒破壞以啟動雙重端粒特異性抑制。
(2)此外,研究者也利用D-PAAs和二氧化錳設計了一種靶向腫瘤、能夠用于磁共振成像的磁性納米雜化系統。綜上所述,該研究開發的基于D-PAAs的策略能夠實現端粒特異性HCC治療和診斷,有望為納米藥物的設計提供一個新的方法。
Jinguo Zhang. et al. A Poly(amino acid)-Based Nanomedicine Strategy: Telomere-Telomerase Axis Targeting and Magnetic Resonance Imaging in Hepatocellular Carcinoma Treatment. Nano Letters. 2024
DOI: 10.1021/acs.nanolett.4c01767
https://pubs.acs.org/doi/10.1021/acs.nanolett.4c01767



















