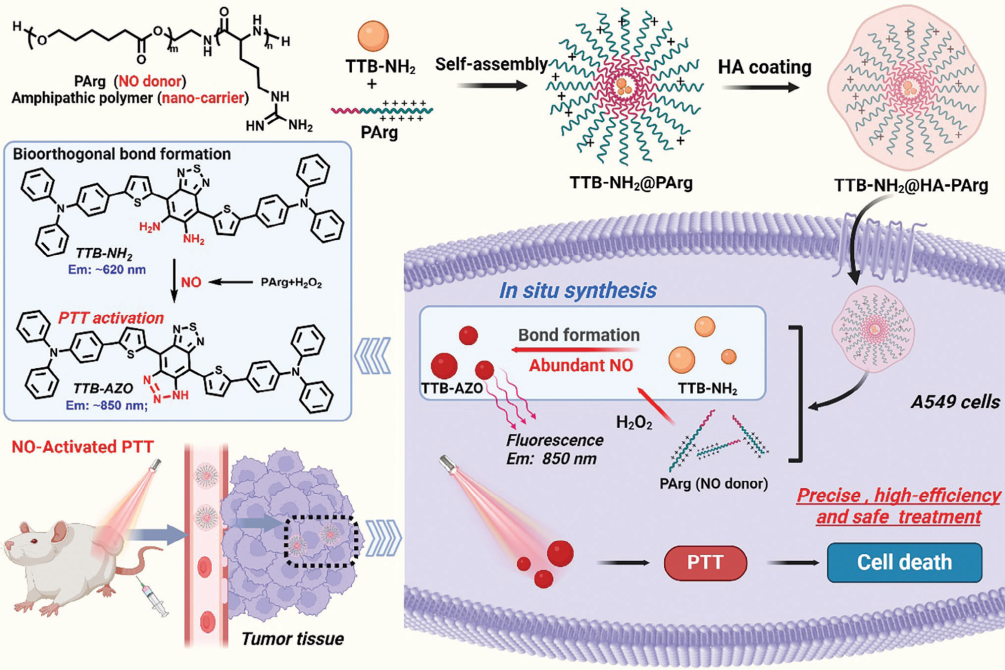
生物正交激活策略在藥物釋放領域中的發展為實現精準、安全的抗癌治療開辟了一條新的途徑。然而,目前仍有兩個顯著的局限性問題嚴重阻礙了該策略的臨床應用:(1)藥物前體及其相應的激活劑必須分開給藥,由此會導致藥物的積累效果不佳和潛在的副作用;(2)需要依賴外源性金屬或有機激活劑來觸發生物正交激活,導致該策略在體內的效率較低,并且會產生全身毒性。有鑒于此,新加坡國立大學劉斌教授和浙江大學平淵教授開發了一種一氧化氮(NO)介導的生物正交共遞送納米組裝體TTB-NH2@PArg,其由前體分子(TTB-NH2)和兩親性多精氨酸(PArg)組成。
本文要點:
(1)TTB-NH2@PArg中的PArg可作為TTB-NH2的自組裝納米載體和NO發生器。在腫瘤微環境(TME)中,TME特異性生成的NO能夠作為氣體激活劑以觸發原位生物正交鍵的形成,進而可以將TTB-NH2轉化為TTB-AZO。
(2)實驗結果表明,腫瘤特異性生成的TTB-AZO不僅能夠作為光熱制劑以有效抑制腫瘤,而且可以誘導熒光變化,從而實現對生物正交激活的實時監測。綜上所述,該研究開發的藥物共遞送方法能夠精準、安全地控制生物正交激活,可提高癌癥治療的療效,并同時最大限度地減少治療副作用。
Bowen Li. et al. Nitric Oxide-Activated Bioorthogonal Codelivery Nanoassembly for In Situ Synthesis of Photothermal Agent for Precise and Safe Anticancer Treatment. Advanced Materials. 2024
DOI: 10.1002/adma.202405502
https://onlinelibrary.wiley.com/doi/10.1002/adma.202405502



















