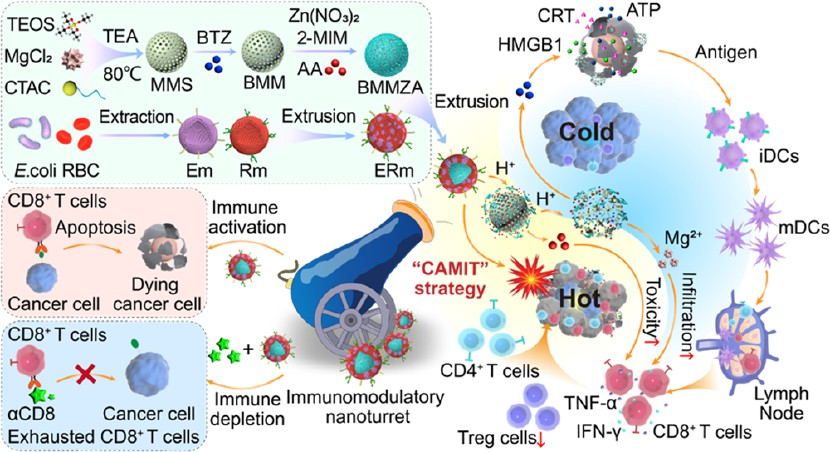
抗壞血酸(AA)因其在T細胞依賴性抗腫瘤免疫中的潛在作用而受到廣泛的關注。然而,過早的血液清除和免疫“冷”腫瘤微環境(TME)等因素仍會嚴重影響AA的免疫治療效果。因此,逆轉具有免疫抑制作用的TME是增強AA免疫治療的關鍵。此外,提高AA免疫治療的有效性也有賴于高效的AA遞送和免疫激活策略。有鑒于此,中國藥科大學范文培教授、東南大學居勝紅教授、武漢大學Nan Lu和南京醫科大學Yazhou Wang將AA固定的金屬有機框架(MOF)門控到負載硼替佐米(BTZ)的鎂摻雜介孔二氧化硅(MMS)納米載體上,設計了一種大腸桿菌外膜囊泡(OMV)-紅細胞(RBC)雜化膜(ERm)偽裝的新型免疫調節納米藥物,其可通過化療輔助、抗壞血酸鹽介導的免疫治療(CAMIT)實現免疫微環境重塑。
本文要點:
(1)在酸性TME中,該納米藥物含有的對酸性敏感的MOF和MMS內核會被逐步降解,以實現具有腫瘤選擇性的AA和BTZ的連續釋放。研究發現,釋放的BTZ可引起免疫原性細胞死亡(ICD),進而能夠與OMV相聯合以協同促進樹突狀細胞(DC)的成熟,并最終與Mg2+共同增加T細胞的腫瘤浸潤。AA則可以進一步激活T細胞,表現出顯著的抗腫瘤和抗轉移能力。
(2)研究者在CD8缺陷小鼠模型中揭示了基于AA的CAMIT策略的T細胞依賴性免疫機制。綜上所述,該研究工作不僅開發了一種多功能仿生混合納米載體,還建立了一種基于多組分驅動的納米藥物的新型免疫調節強化策略,能夠實現T細胞激活增強的AA協同免疫治療。
Wenjing Yao. et al. Hybrid Membrane-Camouflaged Biomimetic Immunomodulatory Nanoturrets with Sequential Multidrug Release for Potentiating T Cell-Mediated Anticancer Immunity. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c04840
https://pubs.acs.org/doi/10.1021/jacs.4c04840



















