
E3泛素連接酶(E3 ubiquitin ligase)催化賴氨酸泛素化反應(yīng),這個反應(yīng)是正常和疾病狀態(tài)下蛋白質(zhì)穩(wěn)定性和細胞信號傳導(dǎo)調(diào)節(jié)的核心。目前人們對于E3機理的認識仍并不充分。有鑒于此,哈佛醫(yī)學(xué)院Philip A. Cole等通過蛋白質(zhì)半合成(protein semisynthesis)、化學(xué)救援法(chemical rescue)、微量熱泳動(microscale thermophoresis)以及其他生物化學(xué)方法研究HECT域E3催化反應(yīng)關(guān)于酸/堿催化功能以及其中的構(gòu)象轉(zhuǎn)化。
本文要點
(1)
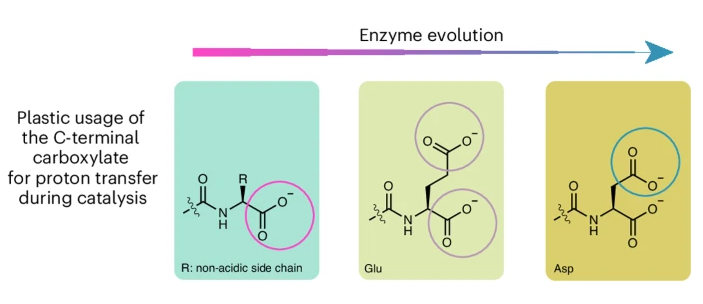
作者研究發(fā)現(xiàn)HECT E3催化泛素連接酶反應(yīng)的過程中,末端側(cè)鏈以及主鏈羧酸鹽在質(zhì)子轉(zhuǎn)移過程中的可塑性,其中酵母Rsp5可能是進化的中間體。此外,HECT域的泛素共價中間體能夠排出E2結(jié)合酶,從而促進催化轉(zhuǎn)化反應(yīng)的發(fā)生。
(2)
這項研究有助于理解蛋白泛素化的關(guān)鍵機理和過程,有助于理解E3的功能以及調(diào)控機理。
參考文獻
Jiang, H., Miller, B.D., Viennet, T. et al. Protein semisynthesis reveals plasticity in HECT E3 ubiquitin ligase mechanisms. Nat. Chem. (2024).
DOI: 10.1038/s41557-024-01576-z
https://www.nature.com/articles/s41557-024-01576-z


















