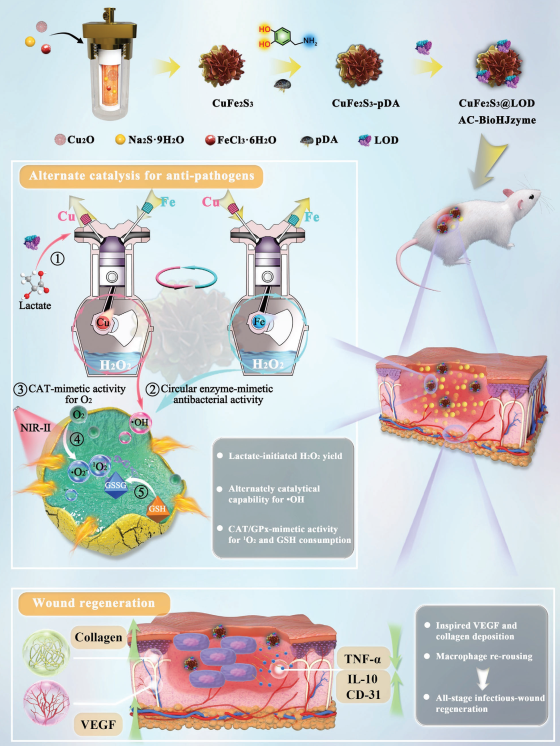
在乏氧的深度創面中,巨噬細胞表型的紊亂和病原菌感染誘發的有害的乳酸副產物會不可避免地導致皮膚再生停滯。有鑒于此,四川大學楊為中教授和鄧怡研究員開發了一種由CuFe2S3和乳酸氧化酶(LOD)組成的析硫化氫(H2S)交替催化生物異質結酶材料(AC-BioHJzyme,CuFe2S3@LOD)。
本文要點:
(1)AC-BioHJzyme具有近紅外二區(NIR-II)光激活的循環模擬酶抗菌(EMA)活性和激活巨噬細胞的能力。在該體系中,LOD能夠消耗細菌厭氧呼吸產生的乳酸,并產生過氧化氫(H2O2)。隨后,該體系可通過類過氧化酶活性將產生的H2O2轉化為具有殺菌作用的?OH。此外,具有類GPx活性的AC-BioHJzyme也能夠消耗谷胱甘肽,以阻斷細菌代謝中的抗氧化系統,而通過類CAT活性產生的O2則能夠在NIR-II照射下生成1O2。
(2)在感染微環境中,CuFe2S3@LOD釋放的H2S氣體能夠將Fe(III)/Cu(II)還原為Fe(II)/Cu(?),從而產生持續的循環EMA活性。體內外實驗結果表明,CuFe2S3@LOD AC-BioHJzyme可通過殺滅細菌、促進上皮化/膠原沉積、改善血管生成和重編程巨噬細胞等方式顯著促進感染性皮膚再生。綜上所述,該研究設計的基于循環模擬酶抗菌和巨噬細胞再激活的策略能夠為促進深部感染創面的愈合提供一個新的方法。
Miaomiao He. et al. A H2S-Evolving Alternately-Catalytic Enzyme Bio-Heterojunction with Antibacterial and Macrophage-Reprogramming Activity for All-Stage Infectious Wound Regeneration. Advanced Materials. 2024
DOI: 10.1002/adma.202405659
https://onlinelibrary.wiley.com/doi/10.1002/adma.202405659



















