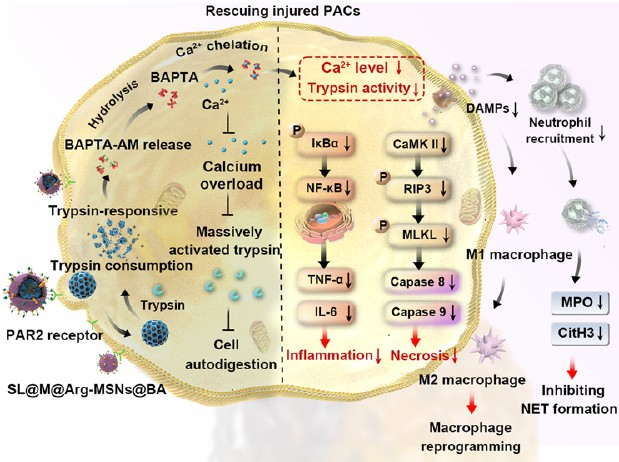
如何將靶向受損胰腺腺泡細胞(PACs)的策略與病理生理特異性藥物治療進行結合是急性胰腺炎(AP)治療面臨的一項重大挑戰。有鑒于此,中國海洋大學何治宇教授利用胰蛋白酶在活性S1口袋上通過Asp189選擇性識別精氨酸上的胍基以及通過催化三聯體切割羧基端(C-端)酰胺鍵的能力,設計并合成了一種由基于精氨酸的酰胺鍵橋接的胰蛋白酶裂解有機二氧化硅前體。
本文要點:
(1)實驗將該前體整合到介孔二氧化硅納米粒子(MSNs)的骨架中,以用于包裹具有膜通透性的Ca2+螯合劑BAPTA-AM(負載量約為43.9%)。研究發現,間充質干細胞膜包覆層和表面修飾的PAC靶向配體使得MSNs具有炎癥募集和精準的PAC靶向性,可在3 h內達到最高的胰腺分布,富集量是裸MSNs的4.7倍。
(2)實驗結果表明,當該仿生MSNs被大量激活的胰蛋白酶降解后,BAPTA-AM會在損傷的PACs中實現按需釋放,以有效消除細胞內鈣過載(降低了81.3%的Ca2+水平),恢復細胞氧化還原狀態,阻斷炎癥級聯反應,并通過阻斷IkBα/NF-kB/TNF-α/IL-6和CaMK-II/p-RIP3/pMLKL/caspase-8,9信號通路抑制細胞壞死。在AP小鼠模型中,單次劑量注射的制劑可以顯著恢復胰腺功能,并將存活率從50%提高到91.6%。綜上所述,該研究開發的制劑能夠為AP治療提供一種具有臨床轉化潛力的新策略。
Yanan Wang. et al. Biomimetic Trypsin-Responsive Structure-Bridged Mesoporous Organosilica Nanomedicine for Precise Treatment of Acute
Pancreatitis. ACS Nano. 2024
DOI: 10.1021/acsnano.4c05369
https://pubs.acs.org/doi/10.1021/acsnano.4c05369



















