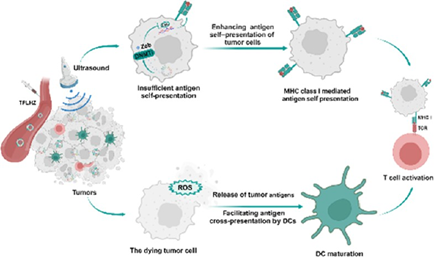
腫瘤細胞抗原的自呈遞不足和樹突狀細胞(DCs)的抗原交叉呈遞無效等問題會導致免疫識別和激活減弱,進而產生免疫治療耐藥性。有鑒于此,河南工業大學張貝貝教授利用由類囊體(TK)/血小板(PLT)膜和包裹DNA甲基轉移酶抑制劑澤布拉林(Zeb)和聲敏劑血卟啉單甲醚(HMME)的脂質體組成的雜化納米囊泡構建了一種超聲激活的原位疫苗。
本文要點:
(1)在局部超聲輻照下,該原位疫苗能夠產生活性氧(ROS),并誘導有效載荷的連續釋放。研究發現,Zeb可有效抑制腫瘤DNA超甲基化,促進主要組織相容性復合體I類(MHC-I)分子介導的抗原自呈遞,以提高免疫識別。
(2)與此同時,TK膜上的過氧化氫酶可將腫瘤過表達的H2O2分解為O2,從而促進ROS的產生,以破壞腫瘤細胞,實現抗原的原位釋放和DCs介導的腫瘤抗原交叉呈遞。綜上所述,該研究構建的原位疫苗能夠同時促進抗原的自呈遞和交叉呈遞,增強抗腫瘤免疫,有效克服腫瘤對免疫治療的耐藥性。
Ge Chen. et al. Ultrasound-Activatable In Situ Vaccine for Enhanced Antigen Self- and Cross-Presentation to Overcome Cancer Immunotherapy Resistance. ACS Nano. 2024
DOI: 10.1021/acsnano.4c04045
https://pubs.acs.org/doi/10.1021/acsnano.4c04045



















