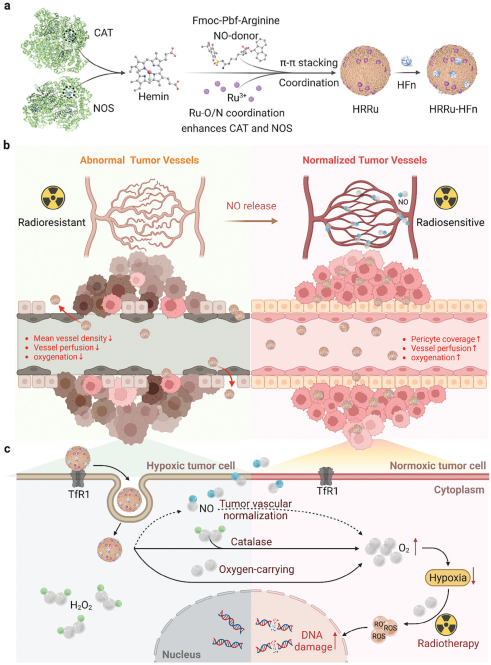
放射治療(RT)是一種能夠治療多種癌癥的重要手段。然而,腫瘤乏氧造成的放療抗性仍會嚴重影響RT的抗腫瘤療效。有鑒于此,鄭州大學江冰教授、中國科學院生物物理研究所范克龍研究員和閻錫蘊院士開發了一種靶向腫瘤的“prosthetic-精氨酸”共組裝納米酶系統,其能夠在腫瘤微環境(TME)中催化生成一氧化氮(NO)和氧(O2),以克服乏氧和增強腫瘤的放射敏感性。
本文要點:
(1)實驗將一氧化氮合酶(NOS)和過氧化氫酶(CAT)的輔基血紅素與提供NO、Fmoc保護的精氨酸與Ru3+離子進行結合,構建了集NOS和CAT等功能于一體的HRRu納米酶。研究發現,表面修飾的人重鏈鐵蛋白(HFn)可提高納米酶(HRRu-HFn)對腫瘤組織的靶向性。在TME中,摻入納米酶的精氨酸可實現由內源性過氧化氫觸發的O2和NO的自主釋放,以提高NO和O2水平,使血管正常化,并改善血液灌注,從而緩解乏氧。
(2)此外,HRRu-HFn納米酶也可以利用血紅素固有的O2轉運能力直接將O2轉運到腫瘤部位。在食管鱗狀細胞癌腫瘤模型中, HRRu-HFn納米酶能夠實現對NO和O2的靶向遞送,并通過二者的協同作用有效對抗腫瘤乏氧,增強放療。綜上所述,該研究設計的基于HRRu-HFn納米酶的方法可以顯著降低RT所需的輻射劑量以及與常規放療相關的治療副作用。
Shuyu Wang. et al. A Self-Catalytic NO/O2 Gas-Releasing Nanozyme for Radiotherapy Sensitization through Vascular Normalization and Hypoxia Relief. Advanced Materials. 2024
DOI: 10.1002/adma.202403921
https://onlinelibrary.wiley.com/doi/10.1002/adma.202403921



















