
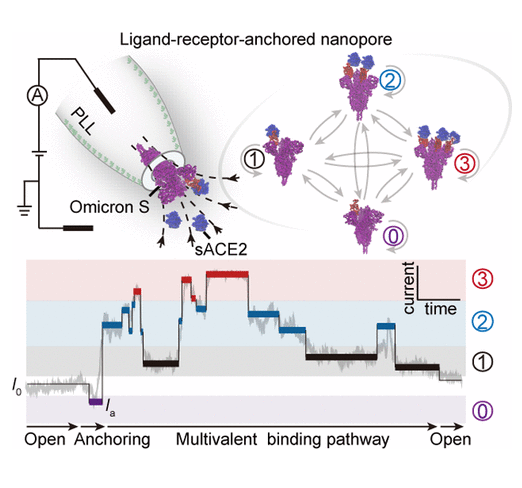
理解單分子的多價態配體與受體之間的相互作用是研究和理解生物界面的分子識別的關鍵。但是,如何實現無標簽的情況研究這種瞬態相互作用非常困難和挑戰。
有鑒于此,南京大學應佚倫教授、Hui Ma等報道配體-受體-螯合的納米孔能夠保持天然狀態下,蛋白的結構柔性,并且允許蛋白質發生有利的取向,從而能夠描述多價動態相互作用。
本文要點
(1)
作者使用四個態的Markov鏈式模型,揭示了Omicron突刺蛋白(Omicron S)在不同濃度的結合路徑,研究了不同濃度下可溶性血管緊張素轉換酶2(sACE2)的結合途徑包括連續結合、共同結合。
(2)
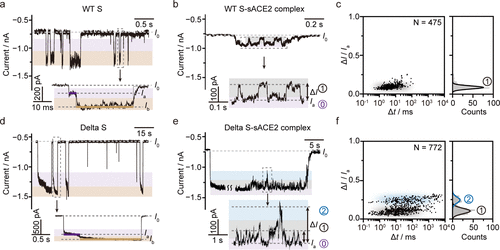
實時的單體動力學分析結果顯示,Omicron S的三個S1單體對sACE2產生非常強的結合親和力(-13.1±0.2 kcal/mol)。這項研究結果說明Omicron S比其他突刺蛋白(WT S和Delta S)具有更高的感染力。sACE2與Omicron S之間的結合有助于促進隨后的結合,這個現象在以往的報道中未曾發現。這項單分子研究揭示了突刺蛋白與sACE2之間的結合親和性,為藥物設計和發展診療技術提供有益幫助。
參考文獻
Hui Ma*, Yongyong Wang, Ya-Xue Li, Bao-Kang Xie, Zheng-Li Hu, Ru-Jia Yu, Yi-Tao Long, and Yi-Lun Ying*, Label-Free Mapping of Multivalent Binding Pathways with Ligand–Receptor-Anchored Nanopores, J. Am. Chem. Soc. 2024
DOI: 10.1021/jacs.4c04934
https://pubs.acs.org/doi/10.1021/jacs.4c04934
應佚倫,1987年6月出生。南京大學化學化工學院教授、博士生導師、化學和生物醫藥創新研究院雙聘PI。入選國家重大人才工程項目;獲聯合國教科文組織“世界最具潛力女科學家”項目(2016年)和國家自然科學基金委優秀青年基金項目(2019年)等資助;2020年獲中國化學會青年化學家獎以及英國皇家化學會期刊Analyst “Emerging Investigator Lectureship”。


















