CRISPR-Cas9技術可以糾正人類突變細胞中的基因,從而實現對多種疾病的治療。然而,目前仍缺乏安全有效的CRISPR-Cas9遞送系統。有鑒于此,沈陽藥科大學孫進教授和孫孟馳教授設計了一種針對腸道中過量水平的TNF-α的口服微納米基因組編輯系統,并將其用于實現對炎癥性腸病(IBD)的特異性基因治療。
本文要點:
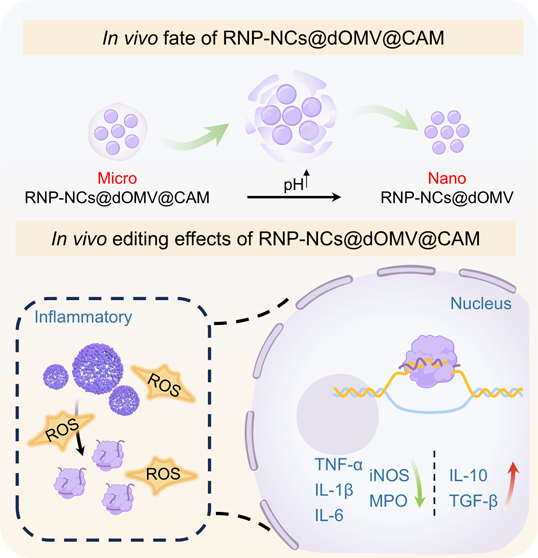
(1)該編輯系統可通過二硫鍵的橋接促進Cas9/sgRNA核糖核蛋白(RNP)組裝成納米簇(NCs)。隨后,研究者將RNP-NCs包裹在來自大腸桿菌Nissle 1917的炎性細胞靶向脂多糖缺失外膜囊泡(dOMVs)中,并進一步利用海藻酸鈣微球(CAMs)外層對其進行屏蔽。得益于CAMs的保護作用,該口服給藥系統在進入胃后能夠抵抗胃酸的降解,以實現高效的靶向腸道給藥。
(2)隨著pH值的逐漸升高,微尺度的CAMs會發生膨脹并分解,進而將包裹在dOMVs中的納米級RNP-NCs釋放到腸道中。實驗結果表明,RNPNCs@dOMVs可穿過粘膜屏障,并靶向炎性巨噬細胞,而被激活的Cas9/sgRNA RNPs則能夠有效地對細胞核內的TNF-α進行基因組編輯。綜上所述,該研究構建的口服微納米基因組編輯系統有望為IBD治療提供一個新的平臺。
Sicen Lin. et al. Oral Microto-Nano Genome-Editing System Enabling Targeted Delivery and Conditional Activation of CRISPR-Cas9 for Gene Therapy of Inflammatory Bowel Disease. ACS Nano. 2024
DOI: 10.1021/acsnano.4c07750
https://pubs.acs.org/doi/10.1021/acsnano.4c07750



















