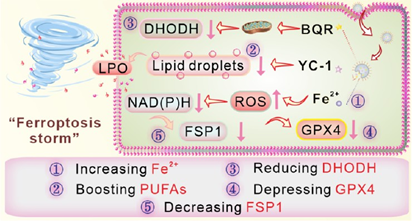
細(xì)胞鐵死亡的激活策略在腫瘤治療領(lǐng)域中具有廣闊的應(yīng)用前景。然而,鐵死亡過程往往會(huì)同時(shí)受到抗鐵死亡物質(zhì)的抑制,包括谷胱甘肽過氧化物酶4(GPX4)、二氫羥酸脫氫酶(DHODH)和鐵死亡抑制蛋白1(FSP1)等。因此,同時(shí)抑制這三種抗鐵死亡物質(zhì)對(duì)于激活鐵死亡而言非常重要,但如何實(shí)現(xiàn)這一目標(biāo)仍是一項(xiàng)極具挑戰(zhàn)性的難題。有鑒于此,福建師范大學(xué)曾雪梅教授和燕雙仟教授研究合理設(shè)計(jì)了一種負(fù)載布喹那(BQR)和利非西呱(YC-1)的中空鐵摻雜SiO2納米酶(FeSHS),即FeSHS/BQR/YC-1-PEG,并將其用于激活腫瘤鐵死亡。
本文要點(diǎn):
(1)實(shí)驗(yàn)通過利用鐵離子連續(xù)蝕刻SiO2納米顆粒構(gòu)建了FeSHS,其具有對(duì)pH/谷胱甘肽響應(yīng)的生物降解性,并且能夠模擬過氧化物酶、谷胱甘肽氧化酶和NAD(P)H氧化酶的活性。研究發(fā)現(xiàn),F(xiàn)eSHS能夠消耗谷胱甘肽和氧化NAD(P)H,進(jìn)而可通過破壞NAD(P)H/FSP1/泛醌軸來抑制GPX4的表達(dá)和FSP1。
(2)此外,釋放的BQR可以抑制DHODH的表達(dá)。與此同時(shí),YC-1能夠通過破壞HIF-1α/脂滴軸增加細(xì)胞的多不飽和脂肪酸(PUFAs)。實(shí)驗(yàn)結(jié)果表明,該納米平臺(tái)能夠在提高鐵和PUFAs水平的同時(shí)破壞GPX4/DHODH/FSP1抑制途徑,進(jìn)而在體內(nèi)外表現(xiàn)出顯著的腫瘤治療效果。綜上所述,該研究工作合理設(shè)計(jì)了一種智能納米平臺(tái),其能夠激活鐵死亡和實(shí)現(xiàn)高效的腫瘤治療。
Panpan Xue. et al. Engineering Biodegradable Hollow Silica/Iron Composite Nanozymes for Breast Tumor Treatment through Activation of the “Ferroptosis Storm”. ACS Nano. 2024
DOI: 10.1021/acsnano.4c08574
https://pubs.acs.org/doi/10.1021/acsnano.4c08574



















