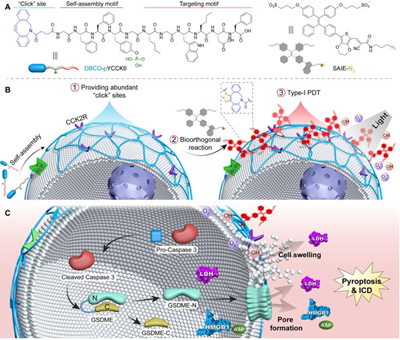
通過生物正交反應在腫瘤細胞膜上富集光敏劑是一種重要的癌癥治療方式。然而,疊氮化物修飾的糖基代謝標記通常缺乏靶向性,并且標記速度相對較慢。此外,可以誘導癌細胞焦亡的膜錨定純I型PS目前仍鮮有報道。有鑒于此,南開大學Yang Shi、丁丹教授和Shaorui Jia開發了一種雙靶向堿性磷酸酶(ALP)和膽囊收縮素-2受體(CCK2R)的肽(DBCO-pYCCK6),它可以選擇性、快速地在癌細胞的細胞膜上發生自組裝,然后在細胞膜上生物正交富集I型聚集誘導發光分子(AIEgen) PSs(SAIE-N3)。
本文要點:
(1)在光照射下,膜錨定的SAIE-N3可以有效地產生I型活性氧(ROS),實現GSDME介導的焦亡。體內實驗結果表明,肽與AIEgen PSs的生物正交組合策略可以顯著抑制腫瘤的生長,并增強CD8+細胞毒性T細胞的浸潤。
(2)綜上所述,該研究設計了一種由自組裝肽介導的新型生物正交反應策略,其可通過應變促進的疊氮-炔環加成(SPAAC)反應將超分子自組裝和AIE領域進行連接,并證明了膜錨定I型PSs可以通過GSDME介導的焦亡實現癌癥治療。
Shenglu Ji. et al. A Membrane-Anchoring Self-Assembling Peptide Allows Bioorthogonal Coupling of Type-I AIEgens for Pyroptosis-Induced Cancer Therapy. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202415735
https://onlinelibrary.wiley.com/doi/10.1002/anie.202415735



















