靶向治療能夠精準靶向腫瘤細胞以提高療效和安全性。然而,由于缺乏合適的靶點,目前能夠接受此類治療的癌癥患者比例仍然很低。有鑒于此,深圳市人民醫(yī)院王繼剛教授、陳純波教授和Zhijie Li對于將免疫原性細胞死亡(ICD)誘導(dǎo)后ICD標志物鈣網(wǎng)蛋白(CALR)從內(nèi)質(zhì)網(wǎng)(ER)向細胞表面的易位作為靶向治療的靶點的可行性進行了探究。
本文要點:
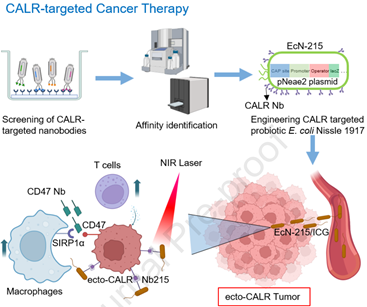
(1)為了靶向CALR,研究者從na?ve VHH噬菌體庫中鑒定出了一種納米抗體Nb215,其對人和小鼠CALR都具有較高的結(jié)合親和力,能夠?qū)σ嫔鶨cN 1917進行工程化修飾。研究發(fā)現(xiàn),將CALR納米抗體修飾的EcN-215與光熱染料吲哚菁綠(ICG)進行偶聯(lián)能夠?qū)崿F(xiàn)NIR-II成像引導(dǎo)的光熱治療(PTT)。
(2)基于EcN-215/ICG的PTT可以通過增強CD45+CD3+ T細胞和CD11b+F4/80+巨噬細胞的浸潤重塑腫瘤微環(huán)境。此外,靶向CALR的EcN-215/ICG也能夠阻斷CD47-SIRPα軸以協(xié)同增強抗腫瘤活性。綜上所述,該研究工作為實現(xiàn)CALR靶向治療提供了概念證明,開發(fā)了一種有望用于治療多種類型癌癥的新方法。
Liuhai Zheng. et al. Reprogramming Tumor Microenvironment with Precise Photothermal Therapy by Calreticulin Nanobody-Engineered Probiotics. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224003430



















