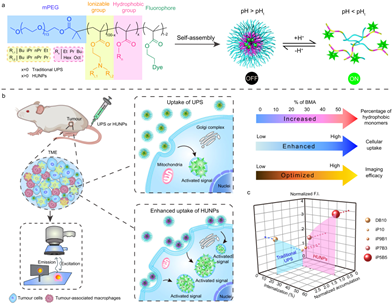
實(shí)現(xiàn)高選擇性、高敏感性的腫瘤檢測(cè)對(duì)于描繪腫瘤邊緣以及在成像引導(dǎo)手術(shù)過(guò)程中識(shí)別轉(zhuǎn)移灶而言非常重要。然而,優(yōu)先在腫瘤中積累的光學(xué)納米探針的成像性能往往會(huì)受到生物信號(hào)低效放大等問(wèn)題的限制。有鑒于此,北京大學(xué)汪貽廣教授開(kāi)發(fā)了一種具有可調(diào)的疏水內(nèi)核、對(duì)pH超敏感的納米探針庫(kù)(HUNPs),并將其用于在多個(gè)腫瘤模型中實(shí)現(xiàn)對(duì)腫瘤微環(huán)境信號(hào)的正交放大。
本文要點(diǎn):
(1)研究發(fā)現(xiàn),用非電離單體調(diào)節(jié)納米顆粒內(nèi)核組成的疏水性可以將HUNPs的細(xì)胞結(jié)合效率提高十倍以上,從而使HUNPs在腫瘤中的細(xì)胞內(nèi)化效率高達(dá)50%。
(2)實(shí)驗(yàn)結(jié)果表明,具有高腫瘤富集和高細(xì)胞內(nèi)化效率的HUNPs能夠產(chǎn)生正交放大的熒光信號(hào),進(jìn)而能夠精確地定位和劃定惡性病變和正常組織之間的邊界,具有高信噪比和分辨率。綜上所述,該研究工作為設(shè)計(jì)具有高細(xì)胞內(nèi)生物利用度、用于癌癥檢測(cè)、藥物/基因遞送和治療的納米藥物提供了一個(gè)新的策略。
Meijie Pan. et al. Tuning nanoparticle core composition drives orthogonal fluorescence amplification for enhanced tumour imaging. Nature Communications. 2024
https://www.nature.com/articles/s41467-024-52029-7



















