光可觸發釋放多種物質(包括可溶性蛋白因子和小分子)以糾正異常的生物事件,從而實現時空可控的局部治療。然而,光穿透深度較差的問題仍會嚴重影響該策略在皮下區域的實施效果,因此研究者需要開發新型的光遞送方法來實現光動力治療藥物釋放。有鑒于此,華盛頓大學Cole A. DeForest和俄勒岡大學Teresa L. Rapp設計了一種利用發光的納米熒光酶(NLuc)和光敏受體分子之間的能量轉移過程(即生物發光共振能量轉移(BRET))驅動水凝膠生物材料釋放生物分子的策略。
本文要點:
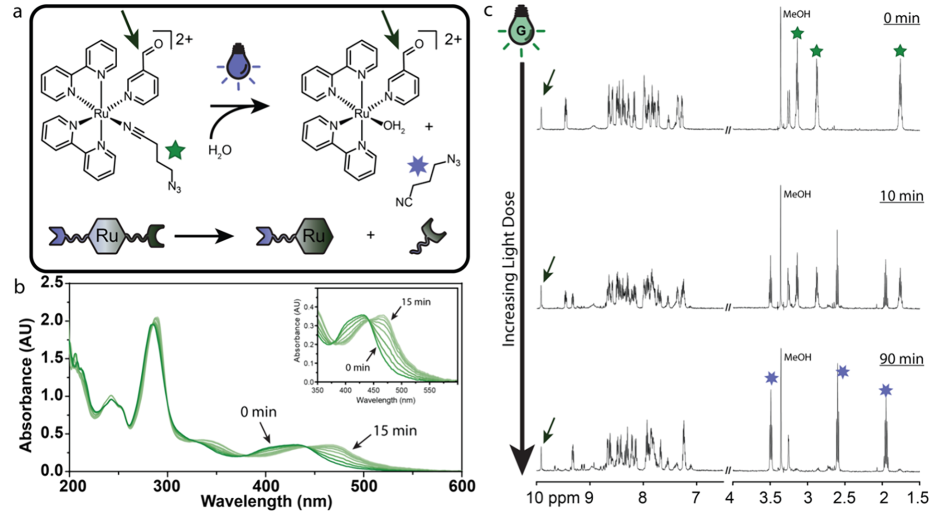
(1)實驗通過簡單、一鍋、高收率(60?70%)的合成策略構建了一種含醛和疊氮化物的雜雙功能釕交聯劑(CHO-Ru-N3),其在藍綠光照射(>550 nm)下能夠發生含疊氮化物配體交換。通過轉肽酶標簽增強的蛋白連接(STEPL)與NLuc進行位點特異性偶聯后,修飾的蛋白進可通過應變促進的疊氮化物-炔環加成(SPAAC)反應共價地連接到聚乙二醇(PEG)基水凝膠上。
(2)利用Ru化合物的高光敏性,研究者證明了表皮生長因子(EGF)可通過直接光照或基于BRET的生物光解實現快速釋放。由于NLuc可以在整個身體中產生可控的發光,因此該研究設計的蛋白質釋放策略有望能夠在小分子全身給藥后實現局部觸發的藥物遞送。
Teresa L. Rapp. et al. Bioluminescence Resonance Energy Transfer (BRET)-Mediated Protein Release from Self-Illuminating Photoresponsive Biomaterials. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c03361
https://pubs.acs.org/doi/10.1021/jacs.4c03361



















