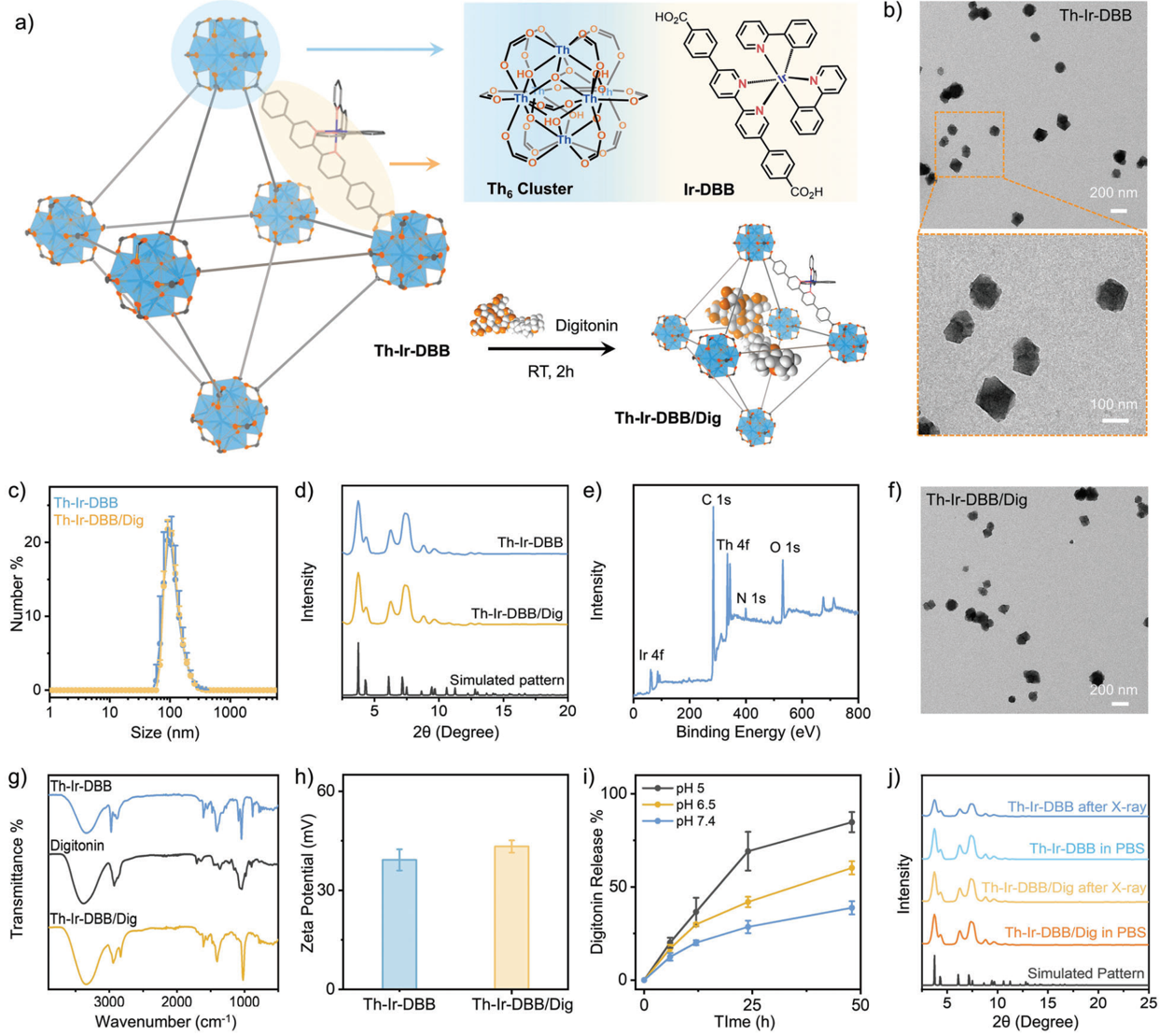
放療(RT)的療效會受到X射線吸收不充分、活性氧產生效率低下、免疫抑制因子上調和還原性腫瘤微環境(TME)等因素的影響。有鑒于此,芝加哥大學林文斌教授開發了一種靶向線粒體。負載洋地黃皂苷(Dig)的納米級金屬有機框架(Th-Ir-DBB/Dig),其能夠在低劑量X射線照射下產生強大的抗腫瘤作用。
本文要點:
(1)Th-Ir-DBB由Th6O4(OH)4二級構建單元(SBUs)和光敏性Ir(DBB)(ppy)22+(Ir-DBB,DBB=4,4′-二(4-苯甲酸)?2,2′-聯吡啶)構建而成,其可通過高原子序數SBUs的強效放射增敏性能產生羥基自由基以及對Ir-DBB配體的有效激發產生單線態氧,進而能夠表現出顯著的RT-放射動力學治療(RDT)效果。
(2)Th-Ir-DBB/Dig可在酸性TMEs中釋放洋地黃皂苷,并通過消耗葡萄糖和谷胱甘肽觸發癌細胞雙硫死亡,使癌細胞對RT-RDT更加敏感。釋放的洋地黃皂苷可同時通過消耗膽固醇下調癌細胞和T細胞中的多個免疫檢查點。實驗結果表明,在X射線照射下,Th-Ir-DBB/dig可誘導產生較強的抗腫瘤免疫,以有效抑制結腸癌和乳腺癌小鼠模型的腫瘤生長。
Wenyao Zhen. et al. Digitonin-Loaded Nanoscale Metal–Organic Framework for Mitochondria-Targeted Radiotherapy-Radiodynamic Therapy and Disulfidptosis. Advanced Materials. 2024
DOI: 10.1002/adma.202405494
https://onlinelibrary.wiley.com/doi/10.1002/adma.202405494



















