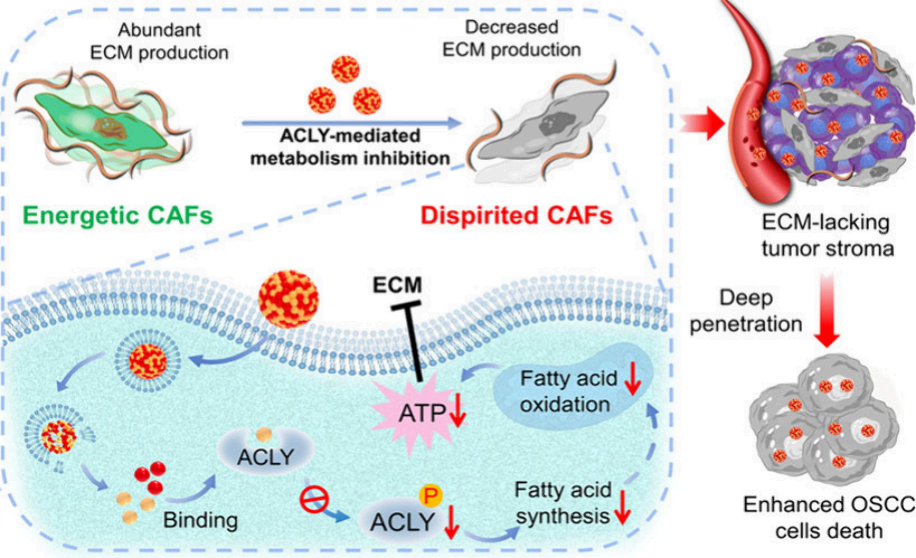
在腫瘤基質(zhì)中,細(xì)胞外基質(zhì)(ECM)的產(chǎn)生升高是影響藥物滲透的關(guān)鍵障礙。武漢大學(xué)尚政軍教授和雒國鳳教授證明了ATP-檸檬酸裂解酶(ACLY)會在癌癥相關(guān)成纖維細(xì)胞(CAFs)中發(fā)生顯著上調(diào)以產(chǎn)生腫瘤ECM,并采用自組裝納米顆粒的設(shè)計(jì)方法將特異性ACLY抑制劑NDI-091143與一線化療藥物(多柔比星(DOX)或紫杉醇(PTX))通過多種非共價(jià)相互作用進(jìn)行組裝,構(gòu)建了無載體納米制劑(CFNA)。
本文要點(diǎn):
(1)到達(dá)富含CAFs的腫瘤部位后,NDI-091143可抑制CAFs的ACLY,進(jìn)而能夠阻斷脂肪酸的從頭合成,以抑制脂肪酸參與的能量代謝過程。
(2)由于缺乏足夠的能量,因此原本充滿活力的CAFs會處于萎靡狀態(tài),無法產(chǎn)生豐富的ECM,從而可以顯著改善腫瘤內(nèi)的藥物灌注,提高化療的療效。綜上所述,該研究設(shè)計(jì)的組裝藥物策略能夠靶向由CAFs的ACLY介導(dǎo)的代謝途徑,可通過減少腫瘤基質(zhì)增強(qiáng)腫瘤化療。
Lili Yu. et al. Carrier-Free Nanoagent Interfering with Cancer-Associated Fibroblasts’ Metabolism to Promote Tumor Penetration for Boosted Chemotherapy. Nano Letters. 2024
DOI: 10.1021/acs.nanolett.4c03433
https://pubs.acs.org/doi/10.1021/acs.nanolett.4c03433



















