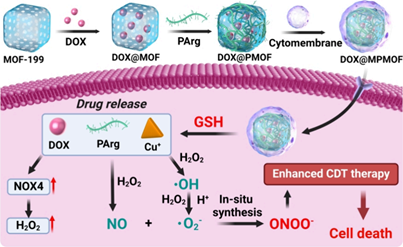
化學動力療法(CDT)可通過芬頓或類芬頓反應產生羥基自由基(·OH)以誘導癌細胞死亡。與傳統療法相比,CDT可以有效克服耐藥性問題,且副作用較低。然而,CDT的臨床應用仍面臨著·OH生成不足以及·OH在體內的壽命短等挑戰。有鑒于此,新加坡國立大學劉斌教授和浙江大學平淵教授開發了一種基于過氧亞硝酸鹽(ONOO?)的CDT納米藥物(DOX@PMOF),該藥物由MOF-199、NO供體(PArg)和煙酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)激活劑(阿霉素,DOX)所組成。
本文要點:
(1)在DOX@PMOF中,MOF-199既是負載DOX的載體,也是觸發CDT的Cu+源。被癌細胞攝取后,高濃度谷胱甘肽(GSH)可將MOF-199還原為Cu+,然后與H2O2反應生成·OH。此外,釋放的DOX也能夠上調NOX4的表達,導致H2O2水平升高,從而促進高效的類芬頓反應以產生足夠的·OH。研究發現,PArg可響應腫瘤微環境產生大量NO,實現NO和·OH級聯,原位合成ONOO?。
(2)與·OH相比,ONOO?毒性更大,壽命和擴散距離也更長,因此能夠實現更有效的CDT。為了進一步提高體內治療效果,研究者在DOX@PMOF上包被了一層同源細胞膜,從而構建了一種腫瘤靶向納米藥物(DOX@MPMOF)。實驗結果表明,該藥物能夠有效抑制腫瘤的生長和轉移,并且具有良好的生物安全性。
Bowen Li. et al. Tumor Microenvironment-Activated In Situ Synthesis of Peroxynitrite for Enhanced Chemodynamic Therapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c10012
https://pubs.acs.org/doi/10.1021/acsnano.4c10012



















