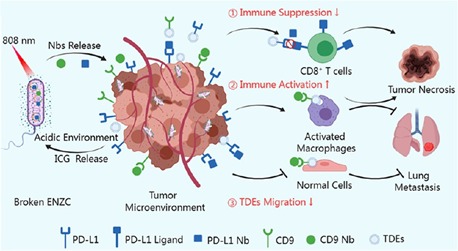
抗PD-L1及其雙特異性抗體能夠產生持久的抗腫瘤免疫。然而,主要由腫瘤源性外泌體(TDEs)引起的免疫抑制仍會嚴重影響該策略的臨床轉化。有鑒于此,南京大學宋玉君教授、Meng Wang和南京醫科大學何幫順教授開發了共表達抗PD-L1和抗CD9納米抗體的工程化大腸桿菌Nissle 1917(EcN),即EcN-Nb,并利用負載吲哚菁綠(ICG)的鋅基金屬有機框架(MOF)對其進行修飾,從而制備了EcN-Nb-ZIF-8CHO-ICG(ENZC),以實現細菌的時空裂解和免疫治療。
本文要點:
(1)歸巢腫瘤的混合系統可響應近紅外(NIR)光以特異性釋放納米抗體,從而能夠靶向TDEs并改變其生物學分布,并將腫瘤相關巨噬細胞重塑為M1狀態,激活具有細胞毒性的T淋巴細胞,以抑制腫瘤的增殖和轉移。
(2)綜上所述,該研究證明了微流控助力的MOF修飾工程化益生菌可以靶向TDEs,并且能夠以時空可控的方式激活抗腫瘤免疫應答,有望為實現靶向TDEs的免疫治療開辟一條新的途徑。
Shurong Qin. et al. Spatiotemporal Delivery of Dual Nanobodies by Engineered Probiotics to Reverse Tumor Immunosuppression via Targeting Tumor-Derived Exosomes. ACS Nano. 2024
DOI: 10.1021/acsnano.4c08117
https://pubs.acs.org/doi/10.1021/acsnano.4c08117



















