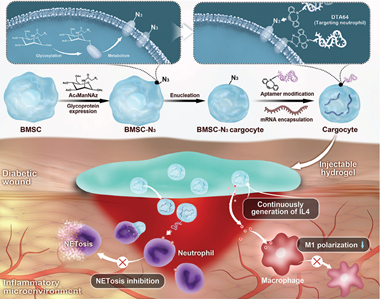
在創面中,由中性粒細胞和巨噬細胞功能障礙引起的持續過度炎癥會在傷口愈合過程中導致難治性反應。然而,以往使用的細胞因子或藥物往往存在半衰期短和靶向性有限等問題,從而導致治療效果不理想。有鑒于此,浙江大學王瑋研究員和易成剛教授利用適體生物正交化學技術對去核間充質干細胞進行工程化,通過細胞膜修飾和在細胞質中負載mRNA構建了一種可精準靶向和持續分泌細胞因子的新型遞送載體(Cargocyte)。
本文要點:
(1)Cargocytes可以通過核酸適體靶向核染色質蛋白DEK蛋白,并維持白細胞介素(IL)-4的表達,從而成功地減少網狀細胞外陷阱生成(NETosis),克服IL-4蛋白的高成本和短半衰期等挑戰,并顯著阻止巨噬細胞向M1表型轉變。
(2)研究者在小鼠和豬傷口模型中對Cargocytes的治療效果進行了證實。實驗結果表明,Cargocytes能夠有效改善傷口免疫微環境。綜上所述,該研究開發的工程化去核間充質干細胞能夠為傷口愈合提供一種高效的遞送系統。
Zhengtai Chen. et al. Engineered Enucleated Mesenchymal Stem Cells Regulating Immune Microenvironment and Promoting Wound Healing. Advanced Materials. 2024
DOI: 10.1002/adma.202412253
https://onlinelibrary.wiley.com/doi/10.1002/adma.202412253



















