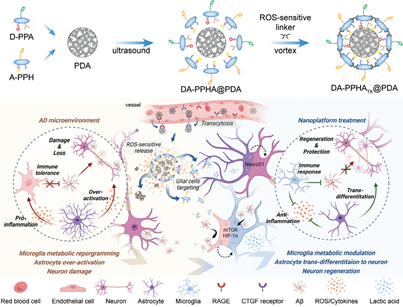
生理屏障的強大保護作用和不明確的致病機制等問題嚴重阻礙了阿爾茨海默病(AD)藥物的開發。作為中樞神經系統的保護者,神經膠質細胞的免疫-代謝功能和干性會在退行過程中保持休眠狀態,從而導致同時實現靶向和調節成為了一項嚴峻的挑戰。有鑒于此,復旦大學蔣晨教授開發了一種由肽-藥物偶聯物和炎癥響應內核組成的模塊化納米平臺。
本文要點:
(1)靜脈給藥后,該納米平臺可通過轉胞吞作用穿過血腦屏障,并在氧化應激微環境中發生分解。研究發現,該納米平臺所釋放的藥物偶聯物模塊可以將羥氯喹(HCQ)和全反式維甲酸(ATRA)分別靶向遞送給小膠質細胞和星形膠質細胞。慢性耐受性小膠質細胞的免疫功能可被代謝調節激活,而反應性星形膠質細胞則會轉分化為功能性神經元。
(2)在轉基因小鼠模型中,該納米平臺可有效降低有毒蛋白和炎癥的水平,并同時增加神經元密度,以顯著改善學習和記憶衰退。綜上所述,該研究開發的模塊化納米平臺能夠為實現炎癥相關疾病的多細胞靶向聯合納米治療提供重要的設計原則。
Peixin Liu. et al. A Peptide-Drug Conjugate-Based Nanoplatform for Immunometabolic Activation and In Situ Nerve Regeneration in Advanced-Stage Alzheimer’s Disease. Advanced Materials. 2024
DOI: 10.1002/adma.202408729
https://onlinelibrary.wiley.com/doi/10.1002/adma.202408729



















