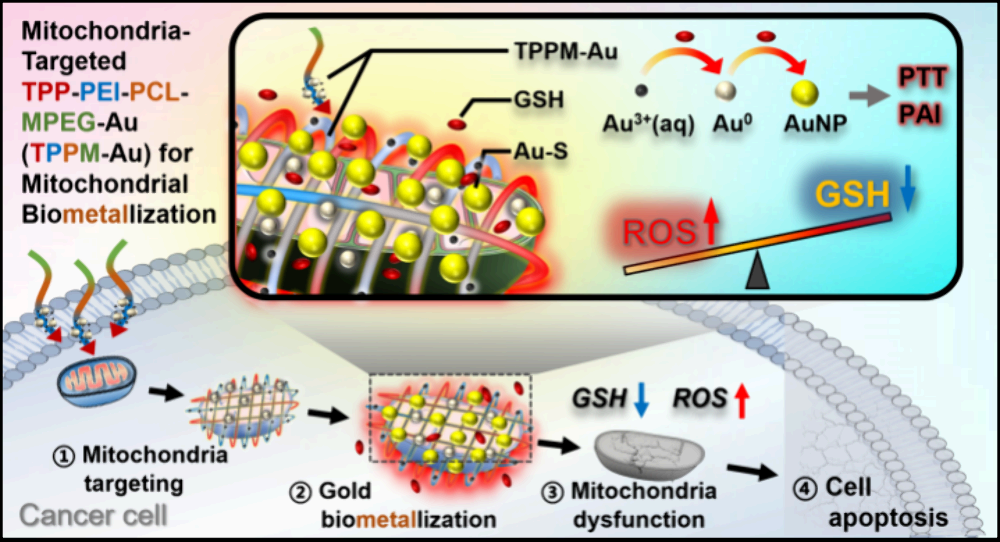
具有細胞干預功能的亞細胞生物礦化系統在癌癥治療領域中具有巨大的應用潛力。然而,缺乏亞細胞特異性、離子濃度高、生物礦化所需的孵育時間長等問題仍會嚴重限制該策略的體內治療效果。有鑒于此,廈門大學霍帥東教授、吳云龍教授和新加坡科技研究局(A*STAR)李子彪研究員開發了一種靶向線粒體的聚合物-金復合物(TPPM-Au),其能夠通過實現線粒體的生物金屬化(機制與生物礦化過程類似)用于體內癌癥治療。
本文要點:
(1)與正常細胞相比,含TPP的TPPM-Au能將更多的Au3+選擇性地遞送到癌細胞的線粒體中。Au3+會迅速礦化形成金納米粒子(GNPs),并消耗大量的抗氧化劑谷胱甘肽(GSH)。研究發現,產生的GNPs可通過與GSH形成Au?S的方式進一步地消耗GSH,導致活性氧(ROS)的積累,從而損害線粒體功能,誘導細胞凋亡。
(2)實驗結果表明,TPPM-Au具有優越的腫瘤穿透性、優異的光熱效率和光聲特性,可通過時空監測的線粒體靶向生物金屬化和光熱療法等過程抑制腫瘤的生長。綜上所述,該研究構建的線粒體靶向金生物金屬化治療平臺能夠為推動亞細胞靶向生物金屬化或生物礦化系統在癌癥治療中的應用提供新的見解。
Zheng Luo. et al. Mitochondria-Targeted Gold Biometallization for Photoacoustically Visualized Photothermal Cancer Therapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c08567
https://pubs.acs.org/doi/10.1021/acsnano.4c08567



















