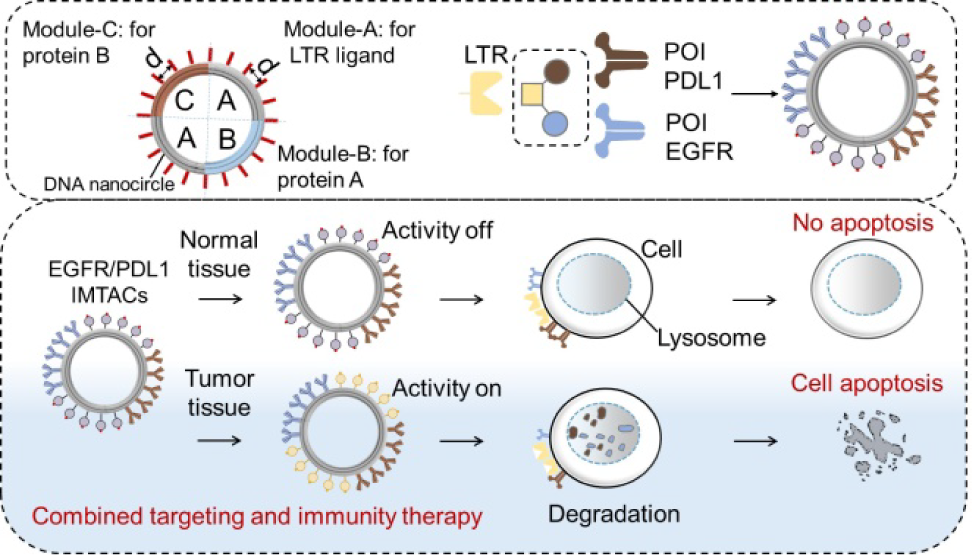
溶酶體靶向嵌合體(LYTACs)是一種能夠消除不可成藥的細胞外腫瘤相關致病蛋白的有效方式。然而,較低的生物利用度和非特異性分布等問題仍會嚴重限制LYTACs在精確腫瘤治療中的療效。開發一種能夠選擇性靶向腫瘤組織并實現模塊化設計的LYTAC系統是一項至關重要但也極具挑戰性的難題。有鑒于此,南京郵電大學晁潔研究員利用智能的模塊化DNA LYTAC(IMTAC)納米器件開發了一種可編程納米平臺,并將其用于實現具有腫瘤特異性的多致病性蛋白質降解。
本文要點:
(1)實驗利用環狀DNA折紙來整合預先設計的模塊化多靶點蛋白結合位點和對pH響應的蛋白降解啟動子,這些啟動子可以在腫瘤組織中特異性識別細胞表面的溶酶體穿梭受體。通過精確控制靶向不同蛋白質的配體和啟動子的化學計量學和模塊性,該IMTAC納米器件能夠實現精準的腫瘤組織定位和遞送。在腫瘤組織中,酸性的腫瘤微環境可觸發降解開關的激活和多價結合,以有效降解多種預先設定的蛋白質。
(2)IMTAC的組織特異性和多配體能夠顯著提高藥物利用率,并同時減少脫靶效應。實驗結果表明,該系統能夠協同降解腫瘤組織中的EGFR和PDL1,以實現對肝細胞癌(HCC)的聯合靶向免疫治療。即使在低濃度條件下,該系統也能在體內顯著誘導腫瘤壞死和抑制腫瘤生長。綜上所述,該研究設計了一種用于制備通用、智能、模塊化的編碼納米平臺的獨特策略,能夠為構建精準的醫學降解物和開發特異性抗腫瘤藥物提供新的見解。
Meirong Cui. et al. Intelligent Modular DNA Lysosome-Targeting Chimera Nanodevice for Precision Tumor Therapy. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c10010
https://pubs.acs.org/doi/10.1021/jacs.4c10010



















