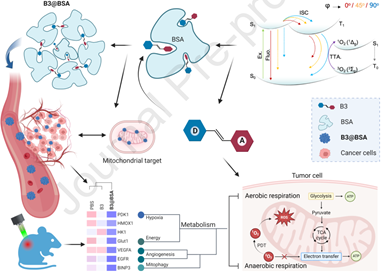
靶向細胞器的光學治療能夠有效地實現腫瘤光學消融,其在再生生物醫學和癌癥治療等領域中具有廣闊的應用前景。然而,如何設計能夠精準定位腫瘤和靶向細胞器的有效光學治療藥物仍是一項極具挑戰性的難題。有鑒于此,西北工業大學李林教授、傅莉教授和西北大學陳希教授設計了一種白蛋白限制線粒體靶向光敏劑納米顆粒(PSs@BSAs),并將其用于實現腫瘤特異性光動力治療。
本文要點:
(1)實驗通過X射線晶體學分析闡明了PSs@BSAs的兩階段組裝機制,并利用飛秒瞬態吸收光譜和量子力學計算揭示了激發態的構象動力學過程。研究發現,PSs@BSAs可以有效地使線粒體活性喪失,并且能夠通過光動力效應進一步破壞腫瘤血管的生成。
(2)實驗結果表明,該過程能夠觸發代謝和氧化應激危機,以促進實體瘤光學消融和抗腫瘤轉移。綜上所述,該研究工作深入探究了化學、物理和生物界面的跨學科問題,能夠為開發用于生物醫學領域的細胞器靶向腫瘤特異性光敏劑提供新的見解。
Bin Fang. et al. Albumins Constrainting the Conformation of Mitochondria-targeted Photosensitizers for Tumor-specific Photodynamic Therapy. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224004484



















