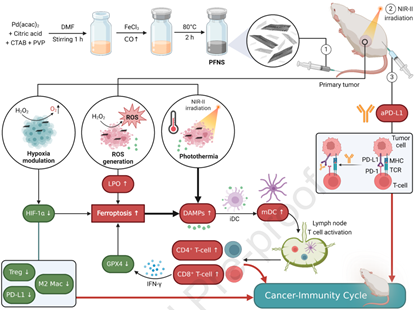
刺激產生強大的癌癥免疫循環(CIC)能夠在癌癥免疫治療過程中引發有效、持久的免疫反應。然而,如何設計一種既能增強腫瘤免疫原性又能減輕免疫抑制的治療性納米材料仍具一項極具挑戰性的難題,并且復雜的材料設計往往也會導致免疫相關的副作用。有鑒于此,南洋理工大學趙彥利教授和Deblin Jana開發了一種含鈀(Pd)和鐵(Fe)的多酶模擬合金納米片,該納米片可以通過克服鐵死亡抗性啟動有效的CIC,進而提高腫瘤的免疫原性,并重編程腫瘤微環境,以實現增強的近紅外二區(NIR-II)光免疫治療。
本文要點:
(1)靜脈給藥后,該納米片可在腫瘤中積累,并通過類過氧化氫酶活性產生氧氣、減少乏氧誘導因子-1α、類M2巨噬細胞、調節性T細胞和程序性死亡配體1(PD-L1)表達等機制對抗乏氧。
(2)實驗結果表明,表面等離激元共振使得該納米片可以實現NIR-II光學治療和光聲成像,并且能夠與鐵死亡和腫瘤微環境重編程相結合,產生與抗PD-L1檢查點阻斷療法相協同的治療作用,以達到優異的抗腫瘤效果。綜上所述,該研究開發了一種通過簡便設計的納米材料進行局部腫瘤治療和提高CIC的新策略。
Yun Chen. et al. Priming of Cancer-Immunity Cycle by Alleviating Hypoxia-induced Ferroptosis Resistance and Immunosuppression. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224004459




















