泛素-蛋白酶體系統(tǒng)(UPS)能夠降解超過70-80%的細(xì)胞蛋白質(zhì)。因此,研究者構(gòu)建了蛋白水解靶向嵌合體(PROTACs),其可通過UPS誘導(dǎo)目標(biāo)蛋白(POIs)發(fā)生泛素化和降解。為了進(jìn)一步增強(qiáng)PROTACs的治療效果,重慶醫(yī)科大學(xué)冉海濤教授、中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院馮和林教授和國家納米科學(xué)中心王海研究員利用能量代謝調(diào)節(jié)來增強(qiáng)腫瘤細(xì)胞中的UPS功能。
本文要點(diǎn):
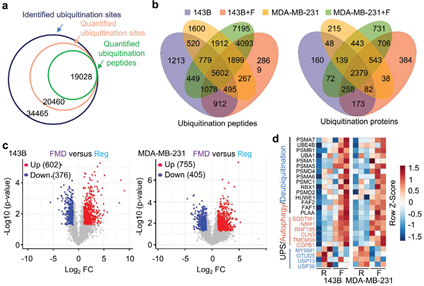
(1)蛋白質(zhì)組學(xué)和泛素組學(xué)分析結(jié)果顯示,在模擬禁食的飲食(FMD)治療后,143B和MDA-MB-231腫瘤細(xì)胞的泛素化蛋白和蛋白酶體活性會顯著升高。因此在FMD處理的143B和MDAMB-231腫瘤細(xì)胞中,靶向粘附斑激酶(FAK-P)或溴結(jié)構(gòu)域蛋白4(BRD4-P)的PROTACs的降解效率顯著增強(qiáng)。
(2)隨后,研究者利用腫瘤細(xì)胞膜修飾二氧化硅包被的氧化鐵納米顆粒,并將其用于靶向遞送PROTACs。磁共振成像(MRI)和熒光成像結(jié)果表明,該納米載體可以在FMD處理的143B或MDA-MB-231腫瘤中有效提高PROTACs的遞送效率。體內(nèi)研究表明,與靶向藥物遞送和FMD治療相聯(lián)合后,F(xiàn)AK-P和BRD4-P的抗腫瘤效果會得到顯著增強(qiáng)。綜上所述,該研究提供了一種能夠提高PROTACs的癌癥治療效率的新策略。
Mixiao Tan. et al. Augmenting Protein Degradation Capacity of PROTAC through Energy Metabolism Regulation and Targeted Drug Delivery. Advanced Materials. 2024
DOI: 10.1002/adma.202412837
https://onlinelibrary.wiley.com/doi/10.1002/adma.202412837



















